
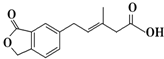
| A. | M可以发生加成、加聚、水解、酯化等反应 | |
| B. | 1mol M最多可以与3mol NaOH反应 | |
| C. | M苯环上的一氯取代物有三种不同结构 | |
| D. | 1mol M最多可以与5mol H2发生加成反应 |
分析 该有机物中含有酯基、苯环、碳碳双键和羧基,具有酯、苯、烯烃和羧酸性质,能发生水解反应、取代反应、加成反应、加聚反应、酯化反应等,据此分析解答.
解答 解:A.碳碳双键和苯环能发生加成反应,碳碳双键能发生加聚反应,酯基能发生水解反应,羧基能发生酯化反应,故A正确;
B.羧基、酯基双键生成的羧基能和NaOH反应,则1molM最多可以与2molNaOH反应,故B错误;
C.苯环没有对称结构,苯环上有3种氢原子,则M苯环上的一氯取代物有三种不同结构,故C正确;
D.碳碳双键和苯环能和氢气发生加成反应,则1mol M最多可以与4mol H2发生加成反应,故D错误;
故选AC.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,侧重考查酯、羧酸和烯烃性质,易错选项是D,注意羧基和酯基中的碳氧双键不能发生加成反应,题目难度不大.


科目:高中化学 来源: 题型:解答题
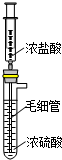 实验室用如图装置制备HCl气体.
实验室用如图装置制备HCl气体.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
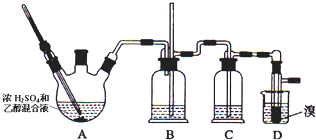
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -1l6 |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
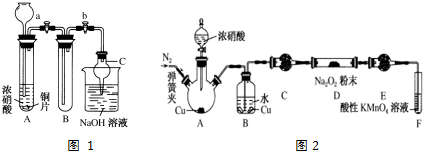
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
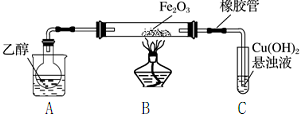
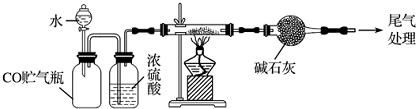
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO、Al2O3的熔点很高,可制作耐高温材料 | |
| B. | 新制氯水久置后变为无色 | |
| C. | 单质硅是光导纤维的主要成分 | |
| D. | 普通玻璃导管口点燃纯净氢气时,火焰呈黄色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 4:3 | C. | 3:2 | D. | 3:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com