
(14分)X,Y,Z,Q,R是五种短周期元素,原子序数依次增大。X,Y两元素最高正价与最低负价代数和均为0;Q与X同主族;Z是地壳中含量最高的非金属元素,R的简单离子在同周期离子中半径最小。请回答下列问题:
(1)画出Z的原子结构示意图??????? ,工业上制取R单质的化学方程式为????????
(2)已知,由X,Y两种元素组成的相对分子质量最小的化合物W 3.2g在氧气中完全燃烧生成稳定化合物(常温常压下)放出178.06KJ的热量,写出W燃烧的热化学方程式???????
(3)由以上某些元素组成的化合物A,B,C,D有如下转化关系: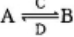 (在水溶液中进行)。其中C是产生温室效应的气体;D是淡黄色固体。写出C的结构式???? ;D的电子式?????
(在水溶液中进行)。其中C是产生温室效应的气体;D是淡黄色固体。写出C的结构式???? ;D的电子式?????
①如果A,B均由三种元素组成,B为两性化合物,且不溶于水,则由A转化为B的离子方程式为????????
②如果A,B均为由以上某些元素组成的盐,则A溶液显 ?? 性,原因是(用离子方程式表示)???? ?????? 。浓度均为0.1mol/L的A,B的溶液等体积混合,混合溶液中离子浓度由大到小的顺序为???????????????? 。
(1) ??? 2Al2O3
??? 2Al2O3 4Al+3O2↑
4Al+3O2↑
(2)CH4(g)+2O2(g)=CO2(g)+2H2O(l)?? ?H=—890.3KJ/mol
(3)O=C=O?? 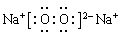
①AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-或2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-
②碱??? CO32-+H2O HCO3-+OH-?? c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
HCO3-+OH-?? c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)
【解析】
试题分析:根据题意可得X是H;Y是C;Z是O;Q是Na;R是Al。(1)8号元素O的原子结构示意图为 ;Al的活动性比较强,在工业上只能用电解熔融的Al2O3的方法进行冶炼。反应的方程式为
;Al的活动性比较强,在工业上只能用电解熔融的Al2O3的方法进行冶炼。反应的方程式为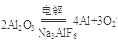 。(2)C、H两元素组成的相对分子质量最小的物质为CH4,3.2g CH4的物质的量为3.2g÷16g/mol=0.2mol.完全燃烧放出178.06KJ的热量。则其燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ? ?H=—890.3KJ/mol。(3)C是产生温室效应的气体,则C为CO2,其的结构式为O=C=O;D是淡黄色固体则D为Na2O2,其电子式为
。(2)C、H两元素组成的相对分子质量最小的物质为CH4,3.2g CH4的物质的量为3.2g÷16g/mol=0.2mol.完全燃烧放出178.06KJ的热量。则其燃烧的热化学方程式为CH4(g)+2O2(g)=CO2(g)+2H2O(l) ? ?H=—890.3KJ/mol。(3)C是产生温室效应的气体,则C为CO2,其的结构式为O=C=O;D是淡黄色固体则D为Na2O2,其电子式为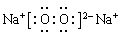 。①如果A,B均由三种元素组成,B为两性化合物,且不溶于水,则A为NaAlO2,B为Al(OH)3.则由A转化为B的离子方程式为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-或2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-。②如果A,B均为由以上某些元素组成的盐,则A为Na2CO3;B为NaHCO3.Na2CO3是强碱弱酸盐,弱酸根离子CO32-水解CO32-+ H2O
。①如果A,B均由三种元素组成,B为两性化合物,且不溶于水,则A为NaAlO2,B为Al(OH)3.则由A转化为B的离子方程式为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-或2AlO2-+3H2O+CO2=2Al(OH)3↓+CO32-。②如果A,B均为由以上某些元素组成的盐,则A为Na2CO3;B为NaHCO3.Na2CO3是强碱弱酸盐,弱酸根离子CO32-水解CO32-+ H2O HCO3-+OH-。消耗水电离产生的H+,当最终达到平衡时,使溶液中的OH-的浓度增大,导致溶液显碱性。若将Na2CO3和NaHCO3等浓度等体积混合,则由于CO32-水解、HCO3-都发生水解反应,所以溶液显碱性,c(OH-)>c(H+);水解程度 CO32->HCO3-,所以c(HCO3-)>c(CO32-)。盐的水解程度是很微弱的,盐的电离作用远大于盐的水解作用,所以c(CO32-)>c(OH-);因为Na+由Na2CO3和NaHCO3共同电离产生,所以c(Na+)>c(HCO3-)。故离子浓度的大小关系为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。
HCO3-+OH-。消耗水电离产生的H+,当最终达到平衡时,使溶液中的OH-的浓度增大,导致溶液显碱性。若将Na2CO3和NaHCO3等浓度等体积混合,则由于CO32-水解、HCO3-都发生水解反应,所以溶液显碱性,c(OH-)>c(H+);水解程度 CO32->HCO3-,所以c(HCO3-)>c(CO32-)。盐的水解程度是很微弱的,盐的电离作用远大于盐的水解作用,所以c(CO32-)>c(OH-);因为Na+由Na2CO3和NaHCO3共同电离产生,所以c(Na+)>c(HCO3-)。故离子浓度的大小关系为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)>c(H+)。
考点:考查元素集化合物的推断;原子结构示意图、结构式、电子式、热化学方程式的书写;金属的冶炼;盐的水解;离子浓度的比较的知识。


科目:高中化学 来源: 题型:


 Z+H2O;写出该反应的化学方程式
Z+H2O;写出该反应的化学方程式



查看答案和解析>>
科目:高中化学 来源:2013届宁夏银川一中高三第一次月考理综化学试卷(带解析) 题型:实验题
(14分)X、Y、Z、W、G、和H均由短周期元素组成,它们是中学化学中常见的气体,具有如下性质:
①X、Y、G能使湿润的蓝色石蕊试纸变红,H能使湿润的红色石蕊试纸变蓝,Z、W不能使湿润的石蕊试纸变色;
②X和H相遇产生白烟;
③Y是形成酸雨的主要气体且能使品红溶液褪色;
④Z和W相遇生成红棕色气体;
⑤G在W中燃烧可以产生Y和H2O;
⑥回答下列问题:
(1) H的化学式是__________,
实验室制取H的化学反应方程式是___________________________________________;
(2)Z的化学式是________,W的化学式是__________________;
(3)⑤中发生反应的化学方程式是___________________________________________;
(4)实验室制备、收集干燥的Y气体,所需仪器如下。装置A产生Y气体,按气流方向连接各仪器接口,顺序为a
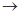
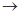
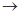
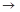 f:
f:
装置D的作用是_ ___,装置E中NaOH溶液的作用是__ ____。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省黄山市高三七校联考化学试卷 题型:填空题
(14分)X、Y、Z、W是元素周期表中前四周期的常见元素,其相关信息如下表;
|
元素 |
相关信息 |
|
X |
X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
|
Y |
原子最外层电子数是次外层的三倍 |
|
Z |
单质及其化合物的焰色反应为黄色 |
|
W |
W元素基态原子的M层全充满,N层只有一个电子 |
⑴ X位于元素周期表第 族。X的一种单质熔点很高,硬度很大,则这种单质的晶体属于 晶体。
⑵ X与Y中电负性较强的是(填元素符号) ;XY2的电子式是 ,分子中存在 个σ键。
⑶Z2Y2中含有的化学键类型有 。阴、阳离子的个数比为 。
⑷W的基态原子核外电子排布式是 。
⑸废旧印刷电路板上有W的单质A。用H2O2和H2SO4的混合溶液可溶出印刷电路板上的A。已知:
A(s)+H2SO4 (aq) == ASO4(aq) + H2(g) ΔH=+64.4kJ·mol-1
2H2O2(l) == 2H2O(l) + O2(g) ΔH= -196.4kJ·mol-1
H2(g)+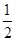 O2(g) == H2O(l) ΔH= -285.8kJ·mol-1
O2(g) == H2O(l) ΔH= -285.8kJ·mol-1
请写出A与H2SO4、H2O2反应生成ASO4(aq)和H2O(l)的热化学方程式(A用化学式表示):
。
查看答案和解析>>
科目:高中化学 来源:09-10年扬州中学高一下学期期末考试化学卷 题型:填空题
(14分)X、Y、Z、L、M五种元素的原子序数依次增大。X、Y、Z、L是组成蛋白质的基础元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)L的元素符号为 ▲ ;M在元素周期表中的位置为 ▲ ;五种元素的原子半径从大到小的顺序是 ▲ (用元素符号表示)。
(2)Z、X两元素按原子数目比l∶3和2∶4构成分子A和B,A的电子式为 ▲ ,B的结构式为 ▲ 。
(3)硒(Se)是人体必需的微量元素,与L同一主族,Se原子比L原子多两个电子层,则Se的原子序数为 ▲ 。
(4)写出由X、Z、L三种元素组成的离子化合物与稀NaOH溶液反应的离子方程式:
▲ 。
(5)Z2H4和ZO2是一种双组分火箭推进剂。两种物质混合发生反应生成Z2和X2O(g),已知8g气体Z2H4在上述反应中放出142kJ热量,其热化学方程式为 ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com