
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象.可以通过下列装置所示实验进行探究.下列说法正确的是( ) 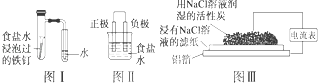
A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl﹣由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl﹣﹣2e﹣═Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O═4Al(OH)3 , 生成的Al(OH)3进一步脱水形成白斑
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】为了探究一氧化氮、二氧化氮、硝酸之间的相互转化,有同学设计了如下实验:如图将少量铜片装入小试管中,再加人适量稀硝酸,然后迅速将大试管倒扣在小试管外.将套好的大、小试管一起竖立在烧杯中,使水浸没大试管口.充分反应完后,通过弯玻璃管往大试管中吹人足量空气,并往烧杯中滴人几滴紫色石蕊试液.试回答:
(1)写出铜片溶于稀硝酸的离子方程式
(2)吹入空气前小试管中的现象是铜片逐渐溶解.溶液变蓝色及
(3)假设小试管中加入了 0.192g铜片和5ml浓度为2mol/L的稀硝酸,则充分反应后小试管内溶 液中NO ![]() 物质的量浓度为mol/L(忽略溶液体积变化).
物质的量浓度为mol/L(忽略溶液体积变化).
(4)若将水换成氢氧化钠溶液,实验过程中生成的一种红棕色气体会与它发生反应,生成两种钠盐和水,且氧化产物与还原产物的物质的量相等,试写出该反应的离子方程式
(5)将等质里的铜片分别与等体积过量的浓、稀硝酸反应(假设溶液体积不变 所得溶液前者呈绿色,后者呈蓝色.某同学认为可能是Cu2浓度的差异引起的,你认为是否正确?(填“正确”或“不正确”),理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘硫化学循环原理如图1所示.
(1)写出反应③的化学方程式 , 一定温度下,向2L密闭容器中加入2mol HI(g),测得n (H2)随时间的变化如图2所示,则该温度下该反应的平衡常数K= .
(2)写出反应①的化学方程式 , 其中SO2体现的是性.
(3)综合①②③三个反应,可看出该化学循环是为了制备某种能源气体,该气体的化学式是 .
(4)氧缺位铁酸铜(CuFe2O4﹣δ)是反应②的良好的催化剂.实验室用如下方法制得:Ⅰ.在Fe(NO3)3和Cu(NO3)2混合溶液中加入一定量KOH溶液,加热
Ⅱ.调节pH并连续搅拌24小时
Ⅲ.过滤、干燥获得铁酸铜(CuFe2O4)
Ⅳ.在氮气保护下、1223K时煅烧CuFe2O4 , 得到CuFe2O3.86
①写出制备得到CuFe2O4的化学方程式
②研究发现:
温度 | 元素存在形式 |
1200﹣1350K | Fe3+部分转变为Fe2+ |
计算CuFe2O3.86中Fe3+与Fe2+的质量百分含量之比为 .
(5)由于该循环中H2SO4与HI发生副反应造成反应器堵塞,因此有科学家用如图3所示原理进行反应.写出阳极的电极反应式 . 请用文字说明在N极能够获得所需物质的原因是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,而辛是由C元素形成的单质.已知:甲+乙=丁+辛,甲+丙=戊+辛;常温下0.1mol/L丁溶液的pH为13,则下列说法正确的是( )
A.元素C形成的单质可以在点燃条件分别与元素A、B、D形成的单质化合,所得化合物均存在共价键
B.元素B、C、D的原子半径由大到小的顺序为:r(D)>r(C)>r(B)
C.1.0 L 0.1 mol/L戊溶液中含阴离子总的物质的量小于0.1 mol
D.1 mol甲与足量的乙完全反应共转移约1.204×1024个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴乙烷在不同溶剂中与NaOH发生不同类型的反应,生成不同的反应产物.
(1)写出溴乙烷在NaOH水溶液中的反应方程式:反应类型 . 某同学取少量溴乙烷与NaOH水溶液反应后的混合溶液,向其中滴加AgNO3 溶液,加热,产生少量沉淀.该同学由此得出溴乙烷与NaOH水溶液反应,生成了溴化钠,你认为是否合理,原因: .
(2)写出溴乙烷在NaOH乙醇溶液中的反应方程式反应类型 . 反应中生成的气体可以用上图所示装置检验,现象是 , 水的作用是 . 除高锰酸钾酸性溶液外,还可以用检验生成的气体,此时还有必要将气体先通入水中吗?(填“有”或“没有”)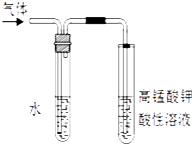
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素性质呈周期性变化的原因是( )
A. 相对原子质量逐渐增大B. 核电荷数逐渐增大
C. 核外电子排布呈周期性变化D. 元素的化合价呈周期性变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示对应化学反应的离子方程式正确的是( )
A.向稀HNO3中滴加Na2SO3溶液SO ![]() +2H+═SO2↑+H2O
+2H+═SO2↑+H2O
B.CuSO4溶液与H2S反应的离子方程式:Cu2++S2﹣═CuS↓
C.氯气溶于水:Cl2+H2═2H++Cl﹣+ClO﹣
D.向CuSO4溶液中加入Na2O2:2Na2O2+2Cu2++2H2═4Na++2Cu(OH)2↓+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁是海水中含量较多的金属元素,单质镁、镁合金以及镁的化合物在科学研究和工业生产中用途非常广泛.
(1)Mg2Ni是一种储氢合金,已知:
Mg(s)+H2(g)=MgH2(s)△H1=﹣74.5kJmol﹣1
Mg2Ni(s)+2H2(g)=Mg2NiH4(s)△H2=﹣64.4kJmol﹣1
Mg2Ni(s)+2MgH2(s)=2Mg(s)+Mg2NiH4(s)△H3
则△H3=kJmol﹣1
(2)工业上可用电解熔融的无水氯化镁获得镁.其中氯化镁晶体脱水是关键的工艺之一.一种正在试验的氯化镁晶体脱水的方法是:先将MgCl26H2O转化为MgCl2NH4ClnNH3 , 然后在700℃脱氨得到无水氯化镁,脱氨反应的化学方程式为;
(3)镁的一种化合物氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等.为了确定实验室制备的Mg(ClO3)26H2O的纯度,做如下试验:
步骤1:准确称量3.50g产品配成100mL溶液.
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000molL﹣1的FeSO4溶液,微热.
步骤3:冷却至室温,用0.100molL﹣1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:Cr2O72﹣+6Fe2++14H+═2Cr3++6Fe3++7H2O.
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL.产品中Mg(ClO3)26H2O的纯度为(用百分号表示,精确到小数点后一位)
(4)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸.在不同温度下催化剂的催化效率与乙酸的生成速率如1图所示.250~300℃时,温度升高而乙酸的生成速率降低的原因是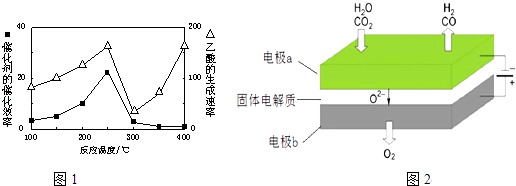
(5)Li2O、Na2O、MgO均能吸收CO2 .
①如果寻找吸收CO2的其它物质,下列建议合理的是
a.可在碱性氧化物中寻找
b.可在ⅠA、ⅡA族元素形成的氧化物中寻找
c.可在具有强氧化性的物质中寻找
②Li2O吸收CO2后,产物用于合成Li4SiO4 , Li4SiO4用于吸收、释放CO2 , 原理是:在500℃,CO2与Li4SiO4接触后生成Li2CO3;平衡后加热至700℃,反应逆向进行,放出CO2 , Li4SiO4再生,说明该原理的化学方程式是
(6)利用反应A可将释放的CO2转化为具有工业利用价值的产品.反应A:CO2+H2O ![]() CO+H2+O2高温电解技术能高效实现(3)中反应A,工作原理示意图如图2:CO2在电极a放电的反应式是 .
CO+H2+O2高温电解技术能高效实现(3)中反应A,工作原理示意图如图2:CO2在电极a放电的反应式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①MgCl2 ②干冰 ③冰 ④Na2O2 ⑤白磷(P4) ⑥硫磺 ⑦Na2CO3 ⑧金刚石 ⑨NaOH ⑩SiO2
(1)以上物质中属于离子晶体的是__________。
(2)属于分子晶体的是____________。
(3)属于原子晶体的是_________(填序号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com