
【题目】信息时代产生的电子垃圾处理不当会对环境构成威胁。某研究小组将废弃的线路板处理后,得到含Cu、Al及少量Fe的金属混合物,并设计如下流程制备硫酸铜和硫酸铝晶体。

请回答:
(1)步骤①~③所涉及的实验操作方法中,属于过滤的是______(填序号)。
(2)步骤①中Cu、Al、Fe均能与稀硫酸和浓硝酸的混合物在加热条件下反应,其中氮元素全部转化为NO。该步骤中稀硫酸的作用是______。
(3)下列关于步骤②的说法正确的是______(填字母)。
a 沉淀B为白色固体
b H2O2的作用是将Fe2+氧化为Fe3+
c 可以用Ba(OH)2溶液替换NaOH溶液
(4)已知AlO2-+ 4H+=Al3+ + 2H2O。由沉淀B制取Al2(SO4)3·18H2O的操作是:将沉淀B转移到烧杯中,______,将溶液加热蒸发、冷却结晶、过滤得到产品。
【答案】②③ 提供H+和SO42 b 加入氢氧化钠溶液至沉淀不再减少,过滤,向所得滤液中加入足量稀硫酸,充分反应
【解析】
第①步稀硫酸、浓硝酸混合酸后加热,Cu、Al、Fe发生反应生成Cu2+、Al3+、Fe3+、Fe2+,所以溶液A中的离子是Cu2+、Al3+、Fe3+、Fe2+;第②步加H2O2的作用是将Fe2+氧化为Fe3+;过氧化氢做氧化剂不引入杂质,对环境无污染,再加入氢氧化钠使Al3+、Fe3+形成氢氧化物沉淀;第③步将硫酸铜溶液蒸发结晶得到五水硫酸铜晶体;在沉淀B中加NaOH和Al(OH)3反应生成NaAlO2,再在滤液中加H2SO4生成Al2(SO4)3,蒸发、冷却、结晶、过滤可得硫酸铝晶体,据此分析解答。
(1)根据上述分析,步骤①~③所涉及的实验操作方法中,步骤②中分离得到了沉淀B,为过滤,步骤③中得到了五水硫酸铜晶体,也是过滤,因此属于过滤的是②和③,故答案为:②③;
(2)步骤①中Cu、Al、Fe均能与稀硫酸和浓硝酸的混合物在加热条件下反应,其中氮元素全部转化为NO,3Cu+8H++2NO3-![]() 3Cu2++2NO↑+4H2O,该步骤中稀硫酸可以提供H+参与反应,同时提供SO42,在③中形成硫酸铜晶体,故答案为:提供H+和SO42;
3Cu2++2NO↑+4H2O,该步骤中稀硫酸可以提供H+参与反应,同时提供SO42,在③中形成硫酸铜晶体,故答案为:提供H+和SO42;
(3)a. 沉淀B的主要成分中有氢氧化铁,是红褐色固体,故a错误;b. H2O2的作用是将Fe2+氧化为Fe3+,便于与铜离子分离,故b正确;c. 如果用Ba(OH)2溶液替换NaOH溶液,则会生成硫酸钡沉淀,因此不可以用Ba(OH)2溶液替换NaOH溶液,故c错误;故答案为:b;
(4)已知AlO2-+ 4H+=Al3+ + 2H2O。由沉淀B制取Al2(SO4)3·18H2O,需要将氢氧化铝和氢氧化铁先分离,可以用氢氧化钠溶解氢氧化铝,过滤除去氢氧化铁固体,然后将溶液酸化即可得到Al2(SO4)3,因此步骤为:将沉淀B转移到烧杯中,加入氢氧化钠溶液至沉淀不再减少,过滤,向所得滤液中加入足量稀硫酸,充分反应,将溶液加热蒸发、冷却结晶、过滤得到产品,故答案为:加入氢氧化钠溶液至沉淀不再减少,过滤,向所得滤液中加入足量稀硫酸,充分反应。


科目:高中化学 来源: 题型:
【题目】温度为T1时,在三个容积均为1 L的恒容密闭容器中仅发生反应 2NO2(g)2NO(g)+O2(g) ΔH>0。实验测得:υ正=υ(NO2)消耗=k正c2(NO2),υ逆=υ(NO)消耗=2υ(O2)消耗=k逆c2(NO)·c(O2),k正、k逆为速率常数,受温度影响。下列说法正确的是( )
容器编号 | 物质的起始浓度(mol·L-1) | 物质的平衡浓度(mol·L-1) | ||
c(NO2) | c(NO) | c(O2) | c(O2) | |
Ⅰ | 0.6 | 0 | 0 | 0.2 |
Ⅱ | 0.3 | 0.5 | 0.2 | |
Ⅲ | 0 | 0.5 | 0.35 | |
A.反应达平衡时,容器Ⅰ与容器Ⅱ中的总压强之比为1∶1
B.反应达平衡时,容器Ⅱ中![]() 比容器Ⅰ中的大
比容器Ⅰ中的大
C.反应达平衡时,容器Ⅲ中NO的体积分数大于50%
D.当温度改变为T2时,若k正=k逆,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①2H2(g)+O2(g)=2H2O(l) ΔH=-572kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) ΔH=-484kJ·mol-1
③CH4(g)+2O2(g)=2H2O(l)+CO2(g) ΔH=-890kJ·mol-1
(1)已知H—H键的键能为436kJ·mol-1,O=O键的键能为496kJ·mol-1,H—O键的键能为463kJ·mol-1,根据上述数据通过键能可直接计算出反应___(填反应序号)的焓变,由反应①②可得出反应比H2O(l)=H2O(g)的焓变ΔH=___。
(2)根据题干可计算出CO2(g)+4H2(g)=CH4(g)+2H2O(g)的焓变ΔH=___。
(3)在①②③三个热化学方程式中,可表示燃烧热的热化学方程式的是___(填序号)。标准状况下,取甲烷和氢气的混合气体11.2L,完全燃烧后恢复到常温,放出的热量为263.8kJ,则混合气体中甲烷和氢气的体积比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】辉钼精矿主要成分是二氧化钼(MoS2),还含有石灰石、石英、黄铜矿(CuFeS2)等杂质。某学习小组设计提取MoS2的过程如下:下列说法错误的是
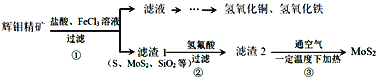
A.为加快辉钼精矿溶解,可将矿石粉粹并适当加热
B.加滤液中含Ca2+、Fe2+、Fe3+、Cu2+、H+等离子
C.以上①②③过程均涉及氧化还原反应
D.步骤③温度不宜过高,以免MoS2被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列数据:
物质 | 熔点/℃ | 沸点/℃ | 密度/ |
乙醇 |
| 78.3 | 0.79 |
乙酸 | 16.6 | 117.9 | 1.05 |
乙酸乙酯 |
| 77 | 0.90 |
某学生在实验室制取乙酸乙酯的主要步骤如下:
①配制![]() 浓硫酸、
浓硫酸、![]() 乙醇(含
乙醇(含![]() )和
)和![]() 乙酸的混合溶液。
乙酸的混合溶液。
②按如图连接好装置(装置气密性良好)并加入混合液,用小火均匀加热![]() 。
。
③待试管乙收集到一定量产物后停止加热,撤出试管乙并用力振荡,然后静置待分层。
④分离出乙酸乙酯,洗涤、干燥。
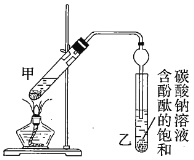
(1)配制①中混合溶液的方法为_______________________________;反应中浓硫酸的作用是____________________________;写出制取乙酸乙酯的反应的化学方程式:____________________________(标出![]() )。
)。
(2)上述实验中饱和碳酸钠溶液的作用是________(填字母)。
A.中和乙酸和乙醇 B.中和乙酸并吸收乙醇
C.减少乙酸乙酯的溶解 D.加速酯的生成,提高其产率
(3)步骤②中需要小火均匀加热,其主要原因是____________________________;步骤③所观察到的现象是_______________________________________;欲将乙试管中的物质分离以得到乙酸乙酯,必须使用的仪器有___________;分离时,乙酸乙酯应从仪器_____________(填“下口放”或“上口倒”)出。
(4)该同学反复实验,得出乙醇与乙酸的用量和得到的乙酸乙酯生成量如下表:
实验 | 乙醇/ | 乙酸/ | 乙酸乙酯/ |
① | 2 | 2 | 1.33 |
② | 3 | 2 | 1.57 |
③ | 4 | 2 | x |
④ | 5 | 2 | 1.76 |
⑤ | 2 | 3 | 1.55 |
表中数据x的范围是__________________;实验①②⑤探究的是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池是化学电源的雏形。关于如图所示原电池的说法正确的是
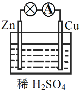
(1)如图连接好装置后,负极材料是__(填“Zn”或“Cu”),铜电极发生的现象:_____。
(2)相应原电池的总反应方程式为____。
(3)下列化学反应可通过原电池装置,可实现化学能直接转化为电能的是__(填序号)
①2NaOH+H2SO4=Na2SO4+2H2O
②Cu+2Fe3+=Cu2++2Fe2+
③C2H5OH+3O2![]() 2CO2+3H2O
2CO2+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热催化合成氨面临的两难问题是:釆用高温增大反应速率的同时会因平衡限制导致NH3产率降低。我国科研人员研制了TiHFe双温区催化剂(Ti-H区域和Fe区域的温度差可超过100℃)。Ti-H-Fe双温区催化合成氨的反应历程如图所示,其中吸附在催化剂表面上的物种用*标注。下列说法正确的是( )
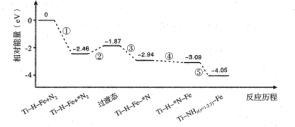
A.①为氮氮三键的断裂过程
B.①②③在低温区发生,④⑤在高温区发生
C.使用Ti-H-Fe双温区催化剂使合成氨反应转变为吸热反应
D.④为N原子由Fe区域向Ti-H区域的传递过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某届奥运会上,有个别运动员因服用兴奋剂被取消参赛的资格。下图是检测出兴奋剂的某种同系物X的结构,关于X的说法正确的是( )
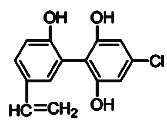
A.X分子中不可能所有原子都在同一平面上
B.X 遇到FeCl3溶液时显紫色,而且能使溴的四氯化碳溶液褪色
C.1 mol X 与足量的浓溴水反应,最多消耗5 mol Br2
D.1 mol X在一定条件下与足量的氢气反应,最多消耗1 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将NaOH固体分别加入浓度均为0.1 mol·L-1、体积均为100 mL的两种一元酸HX、HY的溶液中,lg![]() 随加入NaOH的物质的量的变化情况如图所示。下列叙述正确的是( )
随加入NaOH的物质的量的变化情况如图所示。下列叙述正确的是( )
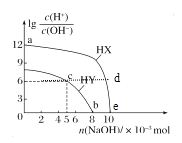
A.由a点到e点水的电离程度先增大后减小
B.d点溶液中存在:c(HX)+c(X-)=0.1mol/L
C.c点溶液中存在:c(Y-)+2c(OH-)=2c(H+)+c(HY)
D.b点溶液中存在:c(HY)+c(Na+)=0.1mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com