
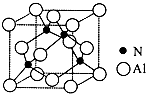
 Ⅰ. 已知氮化铝的晶胞结构如图所示,请回答下列问题.
Ⅰ. 已知氮化铝的晶胞结构如图所示,请回答下列问题.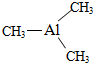 ,则其
,则其分析 (1)A.氮化铝晶胞中配位数是4,NaCl晶胞中配位数是6;
B.同一主族元素,元素第一电离能随着原子序数增大而减小;
C.同一主族元素,元素电负性随着原子序数增大而减弱;
D.同一主族元素,元素原子半径随着原子序数增大而增大;
(2)(CH3)3Al和NH3在一定条件下反应Al和CH4,根据反应物、生成物及反应条件书写方程式;
(3)氨气分子中N原子价层电子对个数是4且含有一个孤电子对, 中Al原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断空间构型及原子杂化方式;
中Al原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断空间构型及原子杂化方式;
(4)Cr是24号元素,其原子核外有24个电子,3d、4s能级上的电子都是其价电子;
(5)原子个数相等、价电子数相等的微粒互为等电子体;
(6)Cr原子价电子数是6,每个CO分子中提供2个电子;
(7)亮绿色者加入硝酸银后有2/3的氯沉淀析出,暗绿色者能析出$\frac{1}{3}$的氯,紫色者能沉淀出全部的氯,说明亮绿色配合物外界中有2个氯离子,暗绿色配合物外界中有1个氯离子、紫色配合物外界中有3个氯离子.
解答 解:(1)A.氮化铝晶胞中配位数是4,NaCl晶胞中配位数是6,所以二者晶胞结构不同,故A错误;
B.同一主族元素,元素第一电离能随着原子序数增大而减小,所以第一电离能N>Al,故B正确;
C.同一主族元素,元素电负性随着原子序数增大而减弱,所以电负性N>Al,故C正确;
D.同一主族元素,元素原子半径随着原子序数增大而增大,所以半径Al>N,故D错误;
故选BC;
(2)(CH3)3Al和NH3在一定条件下反应Al和CH4,根据反应物、生成物及反应条件书写方程式为:(CH3)3Al+NH3$\stackrel{一定条件下}{→}$AlN+3CH4,
故答案为:(CH3)3Al+NH3$\stackrel{一定条件下}{→}$AlN+3CH4;
(3)氨气分子中N原子价层电子对个数是4且含有一个孤电子对, 中Al原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论知,氨气分子为三角锥形结构,Al原子杂化方式为 sp2,
中Al原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论知,氨气分子为三角锥形结构,Al原子杂化方式为 sp2,
故答案为:三角锥形; sp2;
(4)Cr是24号元素,其原子核外有24个电子,3d、4s能级上的电子都是其价电子,所以其价电子排布式为3d54d1,
故答案为:3d54d1;
(5)原子个数相等、价电子数相等的微粒互为等电子体,所以CN-互为等电子体的是CO和氮气,故选ad;
(6)Cr原子价电子数是6,每个CO分子中提供2个电子,所以n=$\frac{18-6}{2}$=6,
故答案为:6;
(7)亮绿色者加入硝酸银后有2/3的氯沉淀析出,暗绿色者能析出$\frac{1}{3}$的氯,紫色者能沉淀出全部的氯,说明亮绿色配合物外界中有2个氯离子,暗绿色配合物外界中有1个氯离子、紫色配合物外界中有3个氯离子,再结合其配位数知,这三种配合物化学式分别为[CrCl(H2O)5]Cl2•H2O、[CrCl2(H2O)4]Cl•2H2O、[Cr(H2O)6]Cl3,
故答案为:[CrCl(H2O)5]Cl2•H2O;[CrCl2(H2O)4]Cl•2H2O;[Cr(H2O)6]Cl3.
点评 本题考查物质结构和性质,为高频考点,涉及配合物结构判断、等电子体、原子核外电子排布、元素周期律、微粒空间构型判断等知识点,利用价层电子对互斥理论、构造原理等知识点分析解答,注意(7)题配合物中內界和外界区别,会判断配位数.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 、⑤ClCH=CHCl⑥
、⑤ClCH=CHCl⑥ 、⑦
、⑦ 、⑧
、⑧ 、⑨
、⑨

 (或
(或 )
)

 溶解性由大到小的顺序
溶解性由大到小的顺序 >
> >
>
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐类的水解过程是中和反应的逆过程,是吸热过程 | |
| B. | 易水解的盐溶于水后,都抑制了水的电离 | |
| C. | 易水解的盐溶液中,水电离出的以游离态存在的H+和OH-的浓度永远相等 | |
| D. | 易水解的盐溶液肯定不是中性的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  根据图可判断正反应的△H<0 | |
| B. |  根据图,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5 | |
| C. | 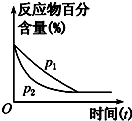 图可表示压强(p)对反应2A(g)+2B(g)?3C(g)+D(s)的影响 | |
| D. |  图为水的电离平衡曲线图,若从A点到C点,可采用在水中加入适量NaOH固体的方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃同系物随着相对分子质量增大,熔点、沸点逐渐升高;常温下的状态由气态递变到液态,相对分子质量大的则为固态 | |
| B. | 烷烃同系物的密度随着相对分子质量增大逐渐增大 | |
| C. | 烷烃跟卤素单质在光照条件下能发生取代反应,它们燃烧时生成二氧化碳和水 | |
| D. | 烷烃同系物都能使溴水、KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达到化学平衡时v正(O2)=v逆(NO) | |
| B. | 若单位时间内生成xmolNO的同时生成 xmolNH3,则反应达到平衡状态 | |
| C. | 达化学平衡时,若增大容器体积,则正反应速率减小,逆反应速率增大 | |
| D. | 若反应发生在体积恒定的密闭容器中,当密度不变时,化学反应达到平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室中“通风厨”能排出有害的气体,能防止有害气体污染大气环境 | |
| B. | 减少碳氢化合物、氮氧化物的排放可以有效的防止光化学烟雾的产生 | |
| C. | 处理废弃塑料制品较为合理的方法是用化学方法将废弃塑料加工成防水涂料或汽油 | |
| D. | 对废弃电池进行集中回收后处理的主要目的是防止重金离子的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳增多使太阳辐射到地球表面的能量增多 | |
| B. | 二氧化碳等气体能释放能量,使大气层的温度升高 | |
| C. | 氟氯烃等大量排放,破坏臭氧层引起的 | |
| D. | 二氧化碳、甲烷等温室气体产生温室效应,使大气温度升高,加速冰层融化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com