
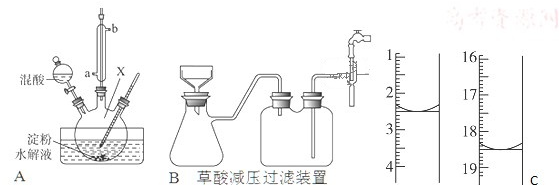
分析 (1)冷凝水流向与蒸气流向逆向时冷凝效果最佳;硝酸易挥发;
(2)草酸具有还原性,硝酸能进一步氧化C6H12O6和H2C2O4;
(3)反应后生成的产物为一氧化氮、二氧化氮,为有毒气体,需要进行尾气处理;
(4)熟悉仪器的图形,说出其名称,依据减压过滤的条件解答;依据减压过滤的正确操作排序解答;
(5)高锰酸钾为紫红色,过程中不需要加指示剂;在酸性条件下,高锰酸根离子能和草酸发生氧化还原反应生成二价锰离子、二氧化碳和水,根据反应计算.
解答 解:(1)冷凝水流向与蒸气流向逆向时冷凝效果最佳,所以应从a口进入;硝酸易挥发,所以需要进行冷凝,
故答案为:a;硝酸;
(2)混酸为65%HNO3与98%H2SO4的混合液,混合液溶于水放热,温度高能加快化学反应,硝酸能进一步氧化H2C2O4成二氧化碳,
故答案为:由于温度过高、硝酸浓度过大,导致C6H12O6 和H2C2O4进一步被氧化;
(3)反应后生成的产物为一氧化氮、二氧化氮,为有毒气体,需要进行尾气处理,所以装置最大的一个缺点缺少尾气处理装置;
故答案为:缺少尾气处理装置;
(4)容器X的名称为三颈烧瓶或吸滤瓶,草酸重结晶的减压过滤装置如图B,通过仪器Y接在水龙头上,起抽气作用,使吸滤瓶、安全瓶中的压强减小;
减压过滤的操作为:②将滤纸放入漏斗并用水湿润;③打开水龙头;①将含晶体的溶液倒入漏斗;⑤拆下橡皮管;④关闭水龙头;
故答案为:三颈烧瓶或吸滤瓶;②③①⑤④;
(5)高锰酸钾溶液为紫红色,当达到滴定终点时,再滴入高锰酸钾溶液时,淡紫色不再褪去,草酸钠(Na2C2O4)溶于稀硫酸中,然后用酸性高锰酸钾溶液进行滴定,离子方程式为:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O,n(KMnO4)=0.016L×0.0200mol•L-1=3.2×10-3mol,根据方程式可得:
2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O.
2 5
3.2×10-3mol 8×10-3mol
样品中二水合草酸的质量为m=8×10-3mol×126g/mol=8×126×10-3g=1.008g,
则该草酸晶体样品中二水合草酸的质量分数为$\frac{1.008g}{1.2g}$×100%=84%,
若滴定前正确读数,滴定后仰视读数,则读取标准溶液的条件增大,计算c(待测)=$\frac{c(标准)V(标准)}{V(待测)}$,结果片高,所测二水合草酸的质量分数偏高,
故答案为:无色;紫红色(或淡紫色);84%,偏高.
点评 本题考查了草酸的制取,把握实验的原理,熟练进行氧化还原计算是解答的关键,注意用结晶法分离固体混合物及其抽滤的实验操作,题目难度较大.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:选择题
| A. | 45.5% | B. | 68.0% | C. | 75.4% | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标况下,1mol的NH3 | B. | 4℃时,18克水 | ||
| C. | 2mol的Al(密度为2.7g•cm-3) | D. | 常温常压下1mol的CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各种物质的量/mol | 达到平衡时体系能量的变化 | |||
| n(A) | n(B) | n(C) | n(D) | ||
| ① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ |
| ② | 0 | 0 | 1 | 4 | 放出热量:Q1 |
| ③ | 1 | 1 | 2 | 1 | 放出热量:Q2 |
| A. | 若容器①中反应10min达到平衡,0~10min时间内,用A表示的平均反应速率v(A)=4.0×10-2mol/(L•min) | |
| B. | 平衡时,①与②容器中A的体积分数相等 | |
| C. | ③达平衡时体系能量的变化主要为热能转化为化学能 | |
| D. | 容器③中,开始时v(B)生成>v(B)消耗 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于$\frac{1}{2}$ | B. | 大于$\frac{1}{2}$,小于1 | C. | 等于$\frac{1}{2}$ | D. | 大于1,小于2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火,立即用泡沫灭火器灭火 | |
| B. | 眼睛里溅进盐酸,应立即用大量水冲洗眼睛 | |
| C. | 易燃试剂与强氧化性试剂分开放置并远离火源 | |
| D. | 在气体发生装置上直接点燃氢气时,必须先检验氢气的纯度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com