
【题目】(1)25 ℃时,制备亚硝酰氯所涉及的热化学方程式和平衡常数如表:
热化学方程式 | 平衡常数 | |
① | 2NO2(g)+NaCl(s) | K1 |
② | 4NO2(g)+2NaCl(s) | K2 |
③ | 2NO(g)+Cl2(g) | K3 |
则该温度下,ΔH3=_______________kJmol-1;K3=_____________(用K1和K2表示)。
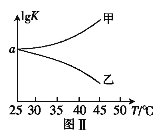
(2)25℃时,在体积为2L的恒容密闭容器中通入0.08 mol NO和0.04 molCl2发生上述反应③,若反应开始与结束时温度相同,数字压强仪显示反应过程中压强(p)随时间(t)的变化如图Ⅰ实线所示,则ΔH3 ___(填“>”“<”或“=”)0;若其他条件相同,仅改变某一条件,测得其压强随时间的变化如图Ⅰ虚线所示,则改变的条件是_____________;在5 min时,再充入0.08 mol NO和0.04 molCl2,则混合气体的平均相对分子质量将_____________(填“增大”、“减小”或“不变”)。图Ⅱ是甲、乙两同学描绘上述反应③的平衡常数的对数值(lgK)与温度的变化关系图,其中正确的曲线是______(填“甲”或“乙”),a值为__________。25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,则此时v正_________v逆(填“>”“<”或“=”)

(3)在300 ℃、8 MPa下,将CO2和H2按物质的量之比1∶3 通入一密闭容器中发生CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
CH3OH(g)+H2O(g)中反应,达到平衡时,测得CO2的平衡转化率为50%,则该反应条件下的平衡常数为Kp=_____(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
【答案】2a-b ![]() < 加入催化剂 增大 乙 2 >
< 加入催化剂 增大 乙 2 > ![]() (MPa)-2
(MPa)-2
【解析】
(1)根据盖斯定律将①×2-②可得:2NO(g)+Cl2(g)2ClNO(g),焓变为倍数关系,而K为指数关系,以此计算K;
(2)由图I分析可知,随反应的进行压强先增大后减小,5min达到平衡状态,推知开始因反应是放热的;由图Ⅰ虚线知:化学反应速率加快,但平衡不移动,判断改变的条件;25℃时,在体积为2L的恒容密闭容器中通入0.08mol NO和0.04molCl2发生反应③,图像中得到5min反应达到平衡状态,开始和平衡状态气体压强之比为6:5,在5min时,再充入0.08mol NO和0.04molCl2,相当于增大压强,根据平衡的移动对物质的量的影响,分析判断平均相对分子质量的变化;根据反应③的平衡常数的对数值(lgK)与温度的变化关系图,由于△H3<0,因此升高温度,平衡逆向移动,结合K的变化分析判断正确的曲线;气体压强之比等于气体物质的量之比,设消耗氯气物质的量x,根据三段式计算出25℃时的平衡常数K,再计算lgK,确定a值;25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,根据Qc与K的相对大小,判断反应进行的方向,确定v正与v逆的大小;
(3)依据三段式列式计算平衡时气体物质的量,压强之比等于气体物质的量之比,计算得到各气体的分压,结合平衡常数概念计算。
(1)已知:①2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g),②4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g),将①×2-②可得:2NO(g)+Cl2(g)2ClNO(g),该反应△H3=2△H1-△H2=2a-b,则平衡常数K3= ![]() ,故答案为:2a-b;
,故答案为:2a-b;![]() ;
;
(2)由图I分析可知,随反应的进行压强先增大后减小,5min达到平衡状态,推知开始因反应是放热的,随着反应的进行,温度逐渐升高,压强增大;反应到一定程度,因反应物浓度减小,随反应正向进行,压强反而减小,到压强随时间变化不变时,达到平衡状态,反应焓变△H<0;根据图Ⅰ虚线知:化学反应速率加快,但平衡不移动,因此改变的条件为加入催化剂;25℃时,在体积为2L的恒容密闭容器中通入0.08mol NO和0.04molCl2发生上述反应③,图像中得到5min反应达到平衡状态,开始和平衡状态气体压强之比为6:5,在5min时,再充入0.08mol NO和0.04molCl2,相当于增大压强,平衡正向进行,气体物质的量减小,气体质量不变,则混合气体的平均相对分子质量将增大;反应③2NO(g)+Cl2(g)![]() 2NOCl(g) ΔH3,由于△H3<0,因此升高温度,平衡逆向移动,K减小,则lgK减小,正确的曲线为乙;气体压强之比等于气体物质的量之比,设消耗氯气物质的量x
2NOCl(g) ΔH3,由于△H3<0,因此升高温度,平衡逆向移动,K减小,则lgK减小,正确的曲线为乙;气体压强之比等于气体物质的量之比,设消耗氯气物质的量x
2NO(g)+Cl2(g)2NOCl(g)
起始量(mol/L) 0.08 0.04 0
变化量(mol/L) 2x x 2x
平衡量(mol/L)0.08-2x0.04-x 2x
(0.08-2x+0.04-x+2x):(0.08+0.04)=5:6,解得:x=0.02mol,平衡常数K3=  =100,lgK= lg100=2,即a=2;25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,此时Qc=
=100,lgK= lg100=2,即a=2;25 ℃时测得反应③在某时刻,NO(g)、Cl2(g)、NOCl(g)的浓度分别为0.8、0.1、0.3,此时Qc=![]() =1.4<K=100,反应向正反应方向进行,v正>v逆,故答案为:<;加入催化剂;增大;乙;;>;
=1.4<K=100,反应向正反应方向进行,v正>v逆,故答案为:<;加入催化剂;增大;乙;;>;
(3)若反应条件为压强8MPa,300℃的反应温度下二氧化碳和氢气按1∶3的比例通入,测得二氧化碳的平衡转化率为50%,结合三段式列式计算,
CO2(g)+3H2(g)CH3OH(g)+H2O(g)
起始量(mol) 1 3 0 0
变化量(mol) 0.5 1.5 0.5 0.5
平衡量(mol) 0.51.5 0.5 0.5
分压=总压×物质的量分数,则P(CO2)=8× ![]() =
= ![]() ,P(H2)=8×
,P(H2)=8×![]() =4,P(CH3OH)=8×
=4,P(CH3OH)=8×![]() =
= ![]() ,P(H2O)=8×
,P(H2O)=8×![]() =
= ![]() ,Kp=
,Kp= ![]() =
=![]() (MPa)-2,故答案为:
(MPa)-2,故答案为:![]() (MPa)-2。
(MPa)-2。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】将一定量的由Cu和Cu2O组成的混合粉末加入到125 mL 2.6 mol·L-1的稀硝酸中,固体完全溶解,得蓝色溶液X并收集到V mL(标准状况)的纯净无色气体Y。下列结论错误的是
A. 纯净无色气体Y与0.75VmL(标准状况)O2混合后通入水中,气体可被完全吸收
B. 若固体与硝酸恰好完全反应,当V=1680时,Cu2O与Cu的物质的量之比为8∶1
C. 原混合粉末的总质量可能为9.8 g
D. 向溶液中加入NaOH溶液,使Cu2+恰好完全沉淀,消耗NaOH的物质的量为(0.325-V/22400)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应H2(g)+I2(g)![]() 2HI(g),在一定温度下由H2(g)和I2(g)开始反应,下列说法正确的是( )
2HI(g),在一定温度下由H2(g)和I2(g)开始反应,下列说法正确的是( )
A. H2(g)的消耗速率与HI(g)的生成速率之比为2∶1
B. 反应进行的净速率是正、逆反应速率之差
C. 正、逆反应速率的比值是恒定的
D. 达到平衡时,不同物质表示的正、逆反应速率一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若用CH3COOD与CH3CH2OH在浓硫酸作用下发生酯化反应,一段时间后分子中存在D原子的是( )
①乙酸,②乙醇, ③乙酸乙酯,④水
A. ①④B. ①③④C. ①②③④D. ①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下图中甲池的总反应式为N2H4+O2===N2+2H2O。甲池中负极上的电极反应式为_________,乙池中石墨电极上发生的反应为_______________。甲池中每消耗0.1 mol N2H4,乙池电极上则会析出_________ g固体。

(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。下图为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的_______极(填“正”或“负”)。F电极上的电极反应式为______________。

(3)下图为电化学法生产硫酸的工艺示意图,电池以固体金属氧化物作电解质,该电解质能传导O2-离子。S(g)在负极生成SO3的电极反应式为____________________。已知S(g)在负极发生的反应为可逆反应,为提高硫蒸气的转化率,该工艺采取的措施有____________(任写一条)。
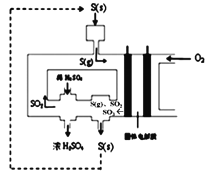
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,将agNH3完全溶于水,得到VmL溶液,设该溶液的密度为ρg·cm-3,质量分数为ω,其中含NH4+的物质的量为bmol。下列叙述中不正确的是
A.溶质的质量分数ω=![]() ×100%
×100%
B.溶质的物质的量浓度c=1000a/17Vmol·L-1
C.溶液中c(OH-)=1000b/Vmol·L-1+c(H+)
D.上述溶液中再加入VmL水后,所得溶液中溶质的质量分数小于0.5ω
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素在自然界中都以典型的盐类存在,包括氟、氯、溴、碘和砹五种元素,位于元素周期表的第ⅦA族,其中氯、溴和碘主要来之海水。卤素元素在生产实际中承担着重要角色。请回答下列问题:
(1)将经过验纯的氢气点燃,伸入盛有氯气的集气瓶中,在集气瓶口可观察到的现象是_________。
(2)欲检验Na2CO3、Na2SO4、NaCl的混合溶液中的Cl-,正确的操作方法是_____________。
(3)海水晒盐所获取的粗盐,经过提纯、精制之后,其水溶液进行电解,可以得到重要的化工原料。请写出该电解反应的离子方程式______。海带中提取碘时,将海带烘干、灼烧目的是_____、_____。
(4)将0.01 molCl2通入含0.03 molNaBr和0.03 molKI的混合液中,发生反应的离子方程式为_____;再将所得溶液分为两等份,其中一份蒸干、灼烧,最后得到的固体的成分一定有KCl,还有___;另一份再加入少量CCl4,振荡,则CCl4层的颜色是____,分离CCl4层和水层的操作名称是__,需要使用的玻璃仪器除烧杯外,还有_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼酸钠晶体(Na2MoO42H2O)是无公害型冷却水系统的金属缓蚀剂,由钼精矿(主要成分是MoS2,含少量PbS等)制备钼酸钠晶体的部分流程如图所示

(1)Na2MoO42H2O中钼元素的化合价为____________。
(2)焙烧时为了使钼精矿充分反应,可采取的措施是____________(答出一条即可)。
(3)焙烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2![]() MoO3+SO2(未配 平),该反应中氧化产物是____________(填化学式);当生成1molSO2时,该反应转移的电子的物质的量为_________mol。利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。阳极的电极反应式为__________________________,在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO42-生成,该反应的离子方程式为____________________________________________________。
MoO3+SO2(未配 平),该反应中氧化产物是____________(填化学式);当生成1molSO2时,该反应转移的电子的物质的量为_________mol。利用下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。阳极的电极反应式为__________________________,在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO42-生成,该反应的离子方程式为____________________________________________________。

(4)碱浸时,MoO3与Na2CO3溶液反应的离子方程式为__________________________。
(5)重结晶得到的母液可以在下次重结晶时重复使用,但达到一定次数后必须净化处理,原因____________________________________。
(6)过滤后的碱浸液结晶前需加入Ba(OH)2固体以除去SO42-,当BaMoO4开始沉淀时, SO42-去除率为97.5%,已知碱浸液中c(MoO42-)=0.40molL-1,c(SO42-)=0.040molL-1,Ksp(BaSO4)=1.0×10-10、则Ksp(BaMoO4)=________________[加入Ba(OH)2固体引起的溶液体积变化可忽略]。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下实验方案,以分离KCl和BaCl2两种固体混合物,试回答下列问题:

供选试剂:Na2SO4溶液、K2CO3溶液、K2SO4溶液、盐酸
(1)操作①的名称是________,操作②的名称是____________。
(2)试剂a是____________(填化学式,下同),试剂b是__________,固体B是____________。
(3)加入试剂a所发生反应的化学方程式为__________________________________。
加入试剂b所发生反应的化学方程式为____________________________________。
(4)该方案能否达到实验目的:__________________________(填“能”或“不能”)。若不能,应如何改进?(若能,此问不用回答)__________。
(5)若要测定原混合物中BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是____的质量。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com