
 、Fe2+、Fe3+等粒子的物质的量随n(Cl2)∶n(FeI2)变化的曲线如图所示。
、Fe2+、Fe3+等粒子的物质的量随n(Cl2)∶n(FeI2)变化的曲线如图所示。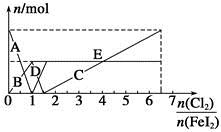
 )= 。
)= 。 )随n(Cl2)∶n(FeI2)变化的情况
)随n(Cl2)∶n(FeI2)变化的情况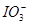 +12H++10Cl-。可见,当n(Cl2)∶n(FeI2)=1时,I-恰好全部被氧化;当n(Cl2)∶n(FeI2)=1.5时,Fe2+恰好全部被氧化;当n(Cl2)∶n(FeI2)=6.5时,氧化还原反应发生完毕。因此,当n(Cl2)∶n(FeI2)>1时,开始生成Fe3+,至n(Cl2)∶n(FeI2)=1.5时,n(Fe3+)达到最大值,故折线E代表了n(Fe3+)随n(Cl2)∶n(FeI2)变化的情况;当n(Cl2)∶n(FeI2)>1.5时,开始生成
+12H++10Cl-。可见,当n(Cl2)∶n(FeI2)=1时,I-恰好全部被氧化;当n(Cl2)∶n(FeI2)=1.5时,Fe2+恰好全部被氧化;当n(Cl2)∶n(FeI2)=6.5时,氧化还原反应发生完毕。因此,当n(Cl2)∶n(FeI2)>1时,开始生成Fe3+,至n(Cl2)∶n(FeI2)=1.5时,n(Fe3+)达到最大值,故折线E代表了n(Fe3+)随n(Cl2)∶n(FeI2)变化的情况;当n(Cl2)∶n(FeI2)>1.5时,开始生成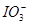 ,至n(Cl2)∶n(FeI2)=6.5时,n(
,至n(Cl2)∶n(FeI2)=6.5时,n(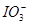 )达到最大值,故线段C代表了n(
)达到最大值,故线段C代表了n(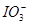 )随n(Cl2)∶n(FeI2)变化的情况。
)随n(Cl2)∶n(FeI2)变化的情况。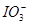 )=6.5。
)=6.5。

科目:高中化学 来源:不详 题型:单选题
| A.氧化还原反应的本质是元素化合价的升降 |
| B.氧化反应与还原反应必然同时发生 |
| C.氧化剂在反应中失去电子,化合价升高,被氧化 |
| D.还原剂具有还原性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2SO4(浓) > Cu2+ > Fe3+ > Br2 | B.H2SO4(浓) > Br2 > Fe3+ > Cu2+ |
| C.Br2 > H2SO4(浓) > Cu2+ > Fe3+ | D.Cu2+ > Fe3+ > Br2 > H2SO4(浓) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温下,甲能从水中置换出氢,而乙不能 |
| B.最高价氧化物对应的水化物碱性比较,甲比乙的强 |
| C.甲与非金属反应时失电子比乙少 |
| D.甲、乙作电极,稀硫酸为电解质溶液组成原电池,乙电极表面产生气泡 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Tl3+>Fe3+>Ag+ | B.Fe3+>Ag+>Tl3+ |
| C.Tl+>Ag+>Fe2+ | D.Tl3+>Ag+>Fe2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.用淀粉—KI试纸和食醋检验加碘盐时淀粉—KI试纸会变蓝 |
| B.足量Cl2能使湿润的、已变蓝的淀粉—KI试纸退色的原因可能是5Cl2+I2+6H2O=2HIO3+10HCl |
| C.由图可知氧化性的强弱顺序为Cl2>I2>IO3- |
| D.途径Ⅱ中若生成1 mol I2,则反应中转移的电子数为10NA |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Tl3+>Fe3+>Ag+ | B.Fe3+>Ag+>Tl3+ |
| C.Tl+>Ag+>Fe2+ | D.Tl3+>Ag+>Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 FeCl3
FeCl3 FeI3
FeI3 FeSO4+Cu
FeSO4+Cu CuCl2+FeCl2
CuCl2+FeCl2 FeCl2+Br2
FeCl2+Br2 FeBr3+I2
FeBr3+I2查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Ag | B.Cu | C.Fe | D.Zn |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com