
【题目】已知有机物A与NaOH的醇溶液混合加热得产物C和溶液D。C与乙烯混合在催化剂作用下可反应生成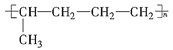 的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
的高聚物。而在溶液D中先加入硝酸酸化,后加AgNO3溶液有白色沉淀生成,则A的结构简式可能为( )
A.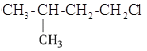 B.
B.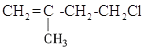
C.CH3CH2CH2ClD.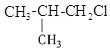
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】元素A和元素B的原子序数都小于18,已知A原子的最外层电子数为a,次外层电子数为b,B原子的M层电子数为![]() ,且
,且![]() ,
,![]() 层电子数为a+b,则下列叙述不正确的是( )
层电子数为a+b,则下列叙述不正确的是( )
A.![]() 元素位于元素周期表中第3周期ⅣA族
元素位于元素周期表中第3周期ⅣA族
B.![]() 、
、![]() 两元素可形成化合物
两元素可形成化合物![]()
C.![]() 、
、![]() 两元素所形成的化合物能与碳反应
两元素所形成的化合物能与碳反应
D.![]() 、
、![]() 两元素所形成的化合物既能与氢氧化钠溶液反应又能与盐酸反应
两元素所形成的化合物既能与氢氧化钠溶液反应又能与盐酸反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知短周期主族元素X、Y、Z、W的原子序数依次增大,X元素原子的最外层电子数是内层电子数的3倍,Y与X能形成两种化合物,Z所在的周期序数与族序数相同。下列说法正确的是( )
A.Y的单质能从Z的盐溶液中置换出Z
B.简单氢化物的热稳定性:![]()
C.Z与X两元素不能形成阴离子
D.简单离子的半径大小:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、M、R、Q是短周期主族元素,部分元素的原子半径和化合价信息如下表所示:
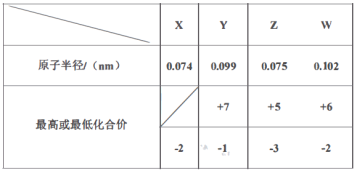
M的焰色反应为黄色:X、Y、R位于周期表中不同周期;Q的单质为半导体材料。
(1)Q元素在周期表中的位置是___;构成化合物M2X2的化学键类型是___。
(2)写出X、Y、R按原子个数之比为1:1:1形成的化合物的电子式___。
(3)Y与W相比,非金属性较强的是___(用元素符号表示),下列事实能证明这一结论的是___(选填字母序号)。
a.常温下W的单质呈固态,Y的单质呈气态
b.Y与W形成的化合物中W呈正价
c.Y和M反应时,lmolY原子所得电子数少于lmolW原子所得电子数
(4)R、W两种元素组成的离子在水溶液中与H+和OH-都不能大量共存,还能与氯水反应,写出其与新制氯水反应的离子方程式___。
(5)Z2R4为二元弱碱,在水中的电离与氨相似,写出其在水中的第一步电离方程式___,Z2R4与磷酸形成的磷酸二氢盐的化学式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属,以铝土矿(主要成分为A12O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如图:

已知:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为__。
(2)“滤渣Ⅰ”的成分有___。
(3)向“过滤Ⅰ”所得滤液中通入足量的CO2,反应的离子方程式为___。
(4)“滤液Ⅱ”中加入足量的CaO,生成的__(填化学式)可循环利用。
(5)“灼烧”的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与资源利用、材料研制、环境保护等密切相关。
(1)海水中蕴含的元素有80多种。
①海水中镁的总储量约为1.8×1015t,海水里镁的存在形式是__(填“游离态”或“化合态”)。
②氯碱工业是重要的化学工业之一,写出该反应原理的离子方程式:__。
(2)材料是人类生存和发展的物质基础,合理使用材料可以改善人类生活。
①铁和铝是两种常见的金属材料,在空气中铝比铁耐腐蚀的原因是__。
②新型陶瓷氮化铝可用氧化铝高温还原法制备,化学方程式如下,请配平该化学反应方程式并标出电子转移方向和数目。_________
Al2O3+C+N2![]() AlN+CO
AlN+CO
(3)保持洁净安全的生存环境已成为全人类的共识。二氧化硫是引起酸雨的一种主要物质,必须严格控制排放。
①写出二氧化硫与足量NaOH溶液反应的离子方程式:__。
②酸雨降落到地面后,其中的亚硫酸在空气中被氧气逐渐氧化生成硫酸,使酸性进一步增强。写出这一过程的化学方程式:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期律的叙述正确的是( )
A.随着元素原子序数的递增,原子最外层电子数从1到8(第1周期元素及过渡元素除外)重复出现
B.随着元素原子序数的递增,元素最高正化合价从+1到+7、负化合价从-7到-1重复出现
C.随着元素原子序数的递增,原子(稀有气体元素原子除外)半径从小到大发生周期性变化
D.元素性质的周期性变化是元素原子核外电子排布周期性变化的必然结果
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 ~ 18号元素(除稀有气体元素外)中的三种元素![]() 、
、![]() 、
、![]() ,已知它们的最高价氧化物对应的水化物的酸性由强到弱的顺序为
,已知它们的最高价氧化物对应的水化物的酸性由强到弱的顺序为![]() ,则下列叙述正确的是( )
,则下列叙述正确的是( )
A.原子半径:![]()
B.非金属性:![]()
C.![]() 、
、![]() 、
、![]() 形成的简单阴离子的还原性逐渐减弱
形成的简单阴离子的还原性逐渐减弱
D.![]() 、
、![]() 、
、![]() 的简单氢化物的稳定性逐渐增强
的简单氢化物的稳定性逐渐增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据事实,回答下列问题。
(1)在25℃、101kPa时,1.0gC8H18(l,辛烷)燃烧生成CO2(g)和H2O(l),放出48.40kJ的热量,则C8H18(l)的燃烧热为___kJ/mol。
(2)已知N2(g)+2O2(g)=2NO2(g);ΔH=+67.7kJ/mol,N2H4(g)+O2(g)=N2(g)+2H2O(g);ΔH=-534kJ/mol,根据盖斯定律写出肼(N2H4)与NO2完全反应生成氮气和气态水的热化学方程式____。
(3)某反应过程中的能量变化如图所示,则该反应是____(填“放热”或“吸热”)反应,判断依据是____。
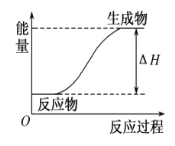
(4)已知:2NH3(g)+3Cl2(g)=N2(g)+6HCl(g) ΔH=–462kJmol-1
![]() ,
,![]()
则断开1molH–N键与断开1molH–Cl键所需能量相差约为_____kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com