
【题目】金属钛(Ti)是一种具有许多优良性能的金属,钛和钛合金被认为是21世纪的重要金属材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态电子排布式可表示为_____。
②与BH4-互为等电子体的阳离子的化学式为_____。
③H、B、Ti原子的第一电离能由小到大的顺序为_____。
(2)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。
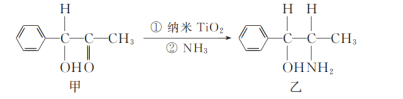
化合物乙的分子中采取sp3杂化方式的原子个数为_____。
(3)水溶液中并没有[Ti(H2O)6)]4+离子,而是[Ti(OH)2(H2O)4]2+离子,1mol[Ti(OH)2(H2O)4]2+中σ键的数目为____。
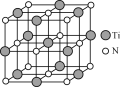
(4)氮化钛(TiN)具有典型的NaCl型结构,某碳氮化钛化合物,结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,则此碳氮化钛化合物的化学式是_____。
【答案】1s22s22p62s23p63d2或[Ar]3d2 NH4+ Ti<B<H 5 16mol Ti4CN3
【解析】
(1)①钛是22号元素,Ti2+核外有20个电子;②BH4-含有5个原子,价电子总数为8,据此分析书写与BH4-互为等电子体的阳离子;③根据第一电离能的变化规律分析判断H、B、Ti原子的第一电离能的大小顺序;
(2)采取sp3杂化方式的原子的价层电子对数=4,据此分析判断分子中采取sp3杂化方式的原子个数;
(3) 配位键属于σ键,1个单键为1个σ键,据此分析判断;
(4)根据均摊法计算晶胞中碳、氮、钛原子数目,进而确定化学式。
(1)①钛是22号元素,Ti2+核外有20个电子,根据构造原理知其基态核外电子排布式为:1s22s22p63s23p63d2,故答案为:1s22s22p63s23p63d2;
②BH4-含有5个原子,价电子总数为8,与BH4-互为等电子体的阳离子为NH4+,故答案为:NH4+;
③同一周期,从左到右,元素的第一电离能呈增大趋势,但第IIA族、第VA族元素的第一电离能大于相邻元素。同族元素,从上至下第一电离能逐渐减小,金属元素的第一电离能小于非金属元素,H、B、Ti原子的第一电离能由小到大的顺序为Ti<B<H,故答案为:Ti<B<H;
(2)化合物乙(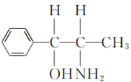 )的分子中采取sp3杂化方式的原子个数有
)的分子中采取sp3杂化方式的原子个数有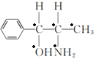 (标记为●的原子采取sp3杂化),共5个,故答案为:5;
(标记为●的原子采取sp3杂化),共5个,故答案为:5;
(3) 1个[Ti(OH)2(H2O)4]2+中含有6个配位键,10个O-H,因此1mol[Ti(OH)2(H2O)4]2+中含有σ键的数目为16mol,故答案为:16mol;
(4) 某碳氮化钛化合物,结构是用碳原子取代氮化钛晶胞顶点的氮原子,利用均摊法可知,晶胞中含有碳原子数为8×![]() =1,含有氮原子数为6×
=1,含有氮原子数为6×![]() =3,含有钛原子数为12×
=3,含有钛原子数为12×![]() +1=4,所以碳、氮、钛原子数之比为1∶3∶4,则该化合物的化学式为Ti4CN3,故答案为:Ti4CN3。
+1=4,所以碳、氮、钛原子数之比为1∶3∶4,则该化合物的化学式为Ti4CN3,故答案为:Ti4CN3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】FeCl3在现代工业生产中应用广泛.某化学研究性学习小组模拟工业流程制备无水FeCl3,再用副产品FeCl3溶液吸收有毒的H2S。
经查阅资料得知:无水FeCl3在空气中易潮解,加热易升华.他们设计了制备无水FeCl3的实验方案,装置示意图(加热及夹持装置略去)及操作步骤如下:
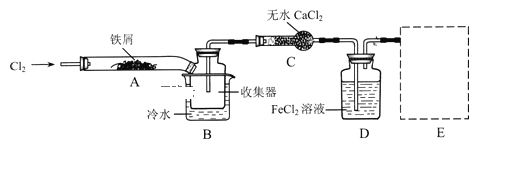
①检验装置的气密性;
②通入干燥的Cl2,赶尽装置中的空气;
③用酒精灯在铁屑下方加热至反应完成;
④…
⑤体系冷却后,停止通入Cl2,并用干燥的N2赶尽Cl2,将收集器密封.
请回答下列问题:
(1)装置A中反应的化学方程式为 _______________________
(2)第③步加热后,生成的烟状FeCl3大部分进入收集器,少量沉积在反应管A右端.要使沉积的FeCl3进入收集器,第④步操作是 ________________________
(3)操作步骤中,为防止FeCl3潮解所采取的措施有(填步骤序号) _________________________
(4)装置B中冷水浴的作用为;_________装置C的名称为 ______________;装置D中FeCl2全部反应后,因失去吸收Cl2的作用而失效,写出检验FeCl2是否失效的试剂:__________________________
(5)在虚线框中尾气吸收装置E所用试剂为____________________________
(6)用含有A12O3、SiO2和少量FeO·xFe2O3的铝灰制备A12(SO4)3·18H2O。,工艺流程如下(部分操作和条件略):
Ⅰ.向铝灰中加入过量稀H2SO4,过滤:
Ⅱ.向滤液中加入过量KMnO4溶液,调节溶液的pH约为3;
Ⅲ.加热,产生大量棕色沉淀,静置,上层溶液呈紫红色:
Ⅳ.加入MnSO4至紫红色消失,过滤;
V.浓缩、结晶、分离,得到产品。
已知:金属离子的起始浓度为0.1mol·L-1
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
根据表中数据解释步骤Ⅱ的目的:______________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关氨气的实验较多,对这些实验的实验原理的分析中,正确的是
A.氨气极易液化的性质可以解释氨气的喷泉实验
B.氨气的还原性可以解释氨气与氯化氢的反应实验
C.NH3H2O的热不稳定性可以解释实验室中用加热氨水的方法制取氨气
D.铵盐的水溶性大是实验室中用NH4Cl和Ca(OH)2的混合物制取氨气的原因
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物R的结构如右所示。下列说法不正确的是

A. R的分子式为C9H8O5
B. R分子中的所有原子可能共平面
C. R能发生酯化、水解、加成反应
D. 与R含有相同取代基的苯环上的位置异构体还有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中的实线表示元素周期表的边界。①~⑧分别表示元素周期表中对应位置的元素。

(1)上述元素所能形成的简单离子中半径最小的是________(填离子符号),最高价氧化物对应水化物酸性最强的是________(填分子式)。
(2)写出④与⑥形成的化合物的形成过程____________________
(3)元素①的氢化物电子式为______________。
(4)④、⑤、⑥各自的最高价氧化物对应的水化物两两皆能反应,它们反应的离子方程式为____________,______________,_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫化钠是重要的化工原料,大多采用无水芒硝(Na2SO4)—炭粉还原法制备,原理为:Na2SO4+2CNa2S+2CO2↑。其主要流程如下:

(1) 上述流程中采用稀碱液比用热水更好,理由是________________________________________________________________________。
(2) 已知:I2+2S2O32-===2I-+S4O62-。所制得的Na2S·9H2O晶体中含有Na2S2O3·5H2O等杂质。为测定产品的成分,进行下列实验,步骤如下:
a. 取试样10.00 g配成500.00 mL溶液。
b. 取所配溶液25.00 mL于碘量瓶中,加入过量ZnCO3悬浊液除去Na2S后,过滤,向滤液中滴入2~3滴淀粉溶液,用0.050 00 mol·L-1 I2溶液滴定至终点,用去5.00 mL I2溶液。
c. 再取所配溶液25.00 mL于碘量瓶中,加入50.00 mL 0.050 00 mol·L-1的I2溶液,并滴入2~3滴淀粉溶液,振荡。用标准Na2S2O3溶液滴定多余的I2,用去15.00 mL 0.100 0 mol·L-1 Na2S2O3溶液。
①步骤b中用ZnCO3除去Na2S的离子方程式为____________。
②判断步骤c中滴定终点的方法为______________。
③计算试样中Na2S·9H2O和Na2S2O3·5H2O的质量分数,写出计算过程__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是

①实验室收集氨气采用图1所示装置
②实验室做氯气与钠的反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A. ②③④B. ①②③C. ①②④D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答下列问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | ④ | ||||
三 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
⑴①元素的名称:_______,⑧元素的符号:_______;
⑵在这些元素中,最活泼的金属元素的离子结构示意图是____,最活泼的非金属元素是____(填元素符号,下同),____是最不活泼的元素;
⑶这些元素的最高价氧化物对应水化物中,______(填化学式,下同)酸性最强,________碱性最强;能形成两性氢氧化物的元素是____(填元素符号);
⑷在⑤到的元素中,_______(填元素符号)原子半径最小;
⑸⑤和⑦两种元素最高价氧化物对应的水化物相互反应的离子方程式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,溶液的酸碱性对TiO2光催化染料R降解反应的影响如图所示。下列判断正确的是

A.在0-50min之间, pH =2 和 PH= 7 时 R 的降解百分率相等
B.溶液酸性越强, R 的降解速率越小
C.R的起始浓度越小,降解速率越大
D.在 20-25min之间, pH = 10 时 R 的平均降解速率为 0.04mol·L-1·min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com