

分析 钛铁矿和浓硫酸反应的产物之一是TiOSO4,加入铁屑,将Fe3+还原为Fe2+,可防止Fe2+氧化,趁热过滤,滤液中含有FeSO4和TiOSO4,冷却结晶,析出FeSO4•7H2O副产品,得到含有TiOSO4的滤液,加入水,加热可水解生成H2TiO3,过滤得到H2TiO3,经煅烧可生成TiO2,用氯气、碳反应可生成TiCl4,高温条件下与镁反应可生成Ti;
(1)浓硫酸具有强氧化性,与Fe2+反应生成Fe3+,加入铁粉可将Fe3+还原成Fe2+;
(2)滤液中含有FeSO4和TiOSO4,冷却结晶,析出FeSO4•7H2O副产品;
(3)TiO2+水解生成H2TiO3和氢离子;
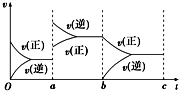
(4)由图象可知,升高温度TiCl4的百分含量减小,说明升高温度平衡向逆反应方向移动,据此判断.
解答 解:(1)浓硫酸具有强氧化性,与Fe2+反应生成Fe3+,加入铁粉可将Fe3+还原成Fe2+,故答案为:将Fe3+还原为Fe2+;
(2)滤液中含有FeSO4和TiOSO4,冷却结晶,得到FeSO4•7H2O晶体,所以副产品为FeSO4•7H2O,故答案为:FeSO4•7H2O;
(3)TiO2+水解生成H2TiO3和氢离子,水解方程式为TiO2++H2O?H2TiO3+2H+,
故答案为:TiO2++H2O?H2TiO3+2H+;
(4)平衡常数仅与温度有关,由图象可知,升高温度TiCl4的百分含量减小,说明升高温度平衡向逆反应方向移动,则平衡常数减小,
故答案为:减小.
点评 本题考查工艺流程,题目难度中等,本题注意分析流程各反应物的转化,题中考查点较多,学习中注重相关知识、方法的积累.


科目:高中化学 来源: 题型:选择题
| A. | 向沸腾的蒸馏水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+ | |
| B. | 向碳酸氢钙溶液中加入过量的氢氧化钠溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| C. | 向Ba(OH)2溶液中滴加NaHSO4溶液至恰好为中性:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 稀硝酸和过量的铁屑反应:Fe+4H++NO3-═Fe3++NO↑+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该混盐的水溶液呈碱性 | |
| B. | 该混盐具有较强的氧化性 | |
| C. | 该混盐中氯元素的化合价为零 | |
| D. | 该混盐与硫酸反应产生71gCl2时转移1mol 电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5 mol白磷(P4,结构如图)含有2NA个P-P键 | |
| B. | 23g钠与在一定条件下与氧气作用,若两者均无剩余,转移NA个电子 | |
| C. | 1mol/L(NH4)2SO4溶液中,含SO2-4NA个,NH+4少于2NA个 | |
| D. | 常温常压下22.4L的CO2在一定条件下与足量的镁反应,转移4NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定温度下,某密闭容器发生如下反应:CaCO3(s)?CaO(s)+CO2(g),达到平衡后,将容器体积缩小为原来的一半,当体系再次达到化学平衡时,CO2的物质的量浓度不变 | |
| B. | 已知某温度下,Kw=l×10-13,若将pH=8的NaOH溶液与pH=5的H2SO4溶液混合,保持温度不变,欲使混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为11:9 | |
| C. | 已知:KSP(AgCl)=1.8×10-10,Ksp(Ag2CrO2)=2.0×10-12,将0.001 mol•L-1的AgNO3溶液滴入0.001mol•L-1 KCl和0.001 rnol•L-1IK2CrO4的混合溶液中,先产生AgCl沉淀 | |
| D. | 已知25℃时,有关弱酸的电离平衡常数:HCNKa=4.9×10-10:H2CO3,Ka1=4.3×10-7,Ka2=5.6×10-11.则CO2通入NaCN溶液中反应的化学方程式为:2NaCN+H2O+CO2═2HCN+Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
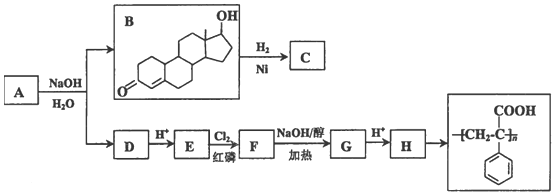
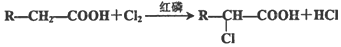
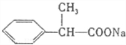 .
. .
.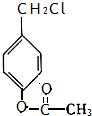 、
、 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=2 | |
| B. | x=18 | |
| C. | M的化学式为MgO | |
| D. | 该反应中Mg5Al3(OH)x(H2O)4既是氧化剂又是还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 (1)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一.
(1)用CO2和氢气合成CH3OCH3(甲醚)是解决能源危机的研究方向之一.| 实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com