
【题目】乙醇分子中各种化学键如图所示,关于乙醇在各种反应中断裂键的说法错误的是( )

A.乙醇和浓硫酸共热到140℃时断键①或者②
B.乙醇在Ag催化下和O2反应断键①和③
C.乙醇和浓硫酸共热到170℃时断键②和③
D.乙醇和乙酸在浓硫酸存在的条件下共热时断键①
科目:高中化学 来源: 题型:
【题目】常见的五种盐A、B、C、D、E,它们的阳离子可能是![]() 、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-。已知:
、NH4+、Cu2+、Ba2+、Al3+、Ag+、Fe3+,阴离子可能是Cl-、NO3-、SO42-、CO32-。已知:
①五种盐均溶于水,水溶液均为无色;
②D的焰色反应呈黄色;③A的溶液呈中性,B、C、E的溶液呈酸性,D的溶液呈碱性;
④若在这五种盐溶液中分别加入Ba(NO3)2溶液,只有A、C的溶液不产生沉淀;
⑤若在这五种盐溶液中分别加入氨水,E和C溶液中生成沉淀,继续加氨水,C中沉淀消失;
⑥把A的溶液分别加入到B、C、E的溶液中,均能生成不溶于稀硝酸的沉淀.
(1)五种盐中所含阴离子相同的两种盐的化学式是______。
(2)D溶液显碱性的原因是______(用离子方程式表示)。
(3)A和C的溶液反应的离子方程式是______,E和氨水反应的离子方程式是______。
(4)若要检验B中所含的阳离子,正确的实验方法是______。
(5)以石墨作电极,电解足量C的溶液,阳极的电极反应式为______,当转移0.2mol电子时,共产生气体______L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去下列物质中所含的少量杂质(括号内为杂质),所选用的试剂和分离方法能达到实验目的的是( )
选项 | 混合物 | 试剂 | 分离方法 |
A | 溴苯(溴) |
| 分液 |
B | 乙醇(水) |
| 过滤 |
C | 甲烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
D | 乙酸乙酯(乙酸) |
| 分液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:X(g)+2Y(g)![]() 3Z(g) H=﹣a kJ·molˉ1(a>0)。下列说法不正确的是( )
3Z(g) H=﹣a kJ·molˉ1(a>0)。下列说法不正确的是( )
A. 0.1 mol X和0.2 mol Y充分反应生成Z,放出能量一定小于0.1 a kJ
B. Y的起始浓度不能为零,平衡浓度也不能为零
C. 在其他条件不变的情况下,降低反应温度,正、逆反应速率均减小,平衡会发生移动
D. 当反应达到平衡状态时,一定存在3v(Y)正=2v(Z)逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2NO2![]() N2O4正反应放热,把烧瓶置于100℃沸水中,下列哪几项性质不会改变( )
N2O4正反应放热,把烧瓶置于100℃沸水中,下列哪几项性质不会改变( )
①颜色②平均相对分子质量③质量④压强
A.①③B.②④C.④D.③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】没食子酸的结构简式如图所示,下列有关没食子酸的说法正确的是( )
![]()
A.没食子酸属于芳香烃
B.没食子酸与足量的溴水反应时,可以消耗1molBr2
C.与碳酸氢钠溶液反应时,1mol没食子酸可生成4molCO2
D.1mol没食子酸与足量的金属Na反应时,产生标准状况下的氢气44.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电化学法制备LiOH的实验装置如图,采用惰性电极,a口导入LiCl溶液,b口导入LiOH溶液,下列叙述正确的是( )
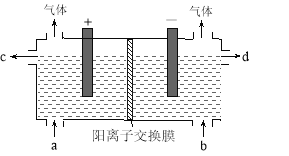
A.通电后阳极区溶液pH增大
B.阴极区的电极反应式为4OH-–4e-=O2↑+2H2O
C.当电路中通过1mol电子的电量时,会有0.25mol的Cl2生成
D.通电后Li+通过交换膜向阴极区迁移,LiOH浓溶液从d口导出
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性:苯甲酸>碳酸>苯酚,现将![]() 转变为
转变为![]() 的方法为( )
的方法为( )
A.与稀H2SO4共热后,加入足量的Na2CO3
B.加入足量的NaOH溶液,再通入足量的HCl
C.与足量的NaOH溶液共热后,再通入CO2
D.与稀H2SO4共热后,加入足量的NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向某容积可变的密闭容器中充入1 mol N2和3 mol H2发生反应: N2+3H2![]() 2NH3。下列说法不正确的是
2NH3。下列说法不正确的是
A.升高温度能加快化学反应速率
B.增大体积能减慢化学反应速率
C.充分反应后生成NH3的物质的量小于2 mol
D.达到化学平衡状态时,v(H2)正=v(NH3)逆
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com