
现有含0.1 mol/L的SO32-溶液30 mL,恰好被2×10-3 mol XO4-氧化为SO42-,则元素X在还原产物中的化合价是
A.+4 B.+3 C.+2 D.+1
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2016届重庆市高一上学期期中考试化学试卷(解析版) 题型:选择题
(原创)在遇铝粉能产生大量气体的溶液中,可能大量共存的是
A.Fe2+、Cl-、NO3-、CH3COO- B.Na+、Ca2+、Cl-、CO32-
C.Na+、SO42-、NH4+、HCO3- D.Na+、K+、NO3-、CO32-
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高一上学期12月月考化学试卷(解析版) 题型:实验题
I.纯碱、烧碱等是重要的化工原料。

(1)利用上图所示装置可间接证明二氧化碳与烧碱溶液发生了反应。将A与B连接,打开止水夹,将胶头滴管中的液体挤入烧瓶,此时的实验现象是___________________,
若其他操作不变,将A与C连接,可观察到的现象是__________________________。
(2)向NaOH溶液中通入一定量CO2,结晶后得到白色固体,该白色固体的组成可能是:
A.NaOH和Na2CO3;B. ;C. ;D. 。
(3)设计实验确定(2)中白色固体中存在A项中的阴离子:
实验操作 | 实验现象 | 结论 |
①取少量白色固体于试管中,加足量水溶解,再加足量BaCl2溶液 |
|
|
②
|
|
|
II.化学兴趣小组对某品牌牙膏中的摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙,氢氧化铝组成;牙膏中其他成分遇到盐酸时无气体产生。
牙膏样品中碳酸钙的定量测定:利用下图所示装置(图中夹持仪器略去)进行实验,充分反应
后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。

依据实验过程回答下列问题:
(1)实验过程中需持续缓缓通入空气。其作用除了可搅拌B,C中的反应物外,还有: 。
(2)C中反应生成BaCO3的离子方程式是 。
(3)下列各项措施中,不能提高测定准确度的是( )
A.在加入盐酸之前,应排净装置内的CO2气体
B.滴加盐酸不宜过快
C.在A~B之间增添盛有浓硫酸的洗气装置
D.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(4)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g.则样品中碳酸钙的质量分数为________。
(5)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是 _________________________________。
(6)装置中U形管D中的碱石灰的作用是_____________________________。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省高一上学期12月月考化学试卷(解析版) 题型:选择题
在由NaOH、Na2O2组成的化合物中钠元素的质量分数为58%,则混合物中氢元素的质量分数近似为( )
A.6% B.2% C.4% D.无法确定
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省大连市高一上学期期末考试化学试卷(解析版) 题型:计算题
将6.4 g铜与足量的浓硫酸在加热情况下充分反应,铜没有剩余。试计算:(要求有计算过程)
(1)生成的SO2的体积(标准状况下)。
(2)若用4 mol·L-1的NaOH溶液吸收生成的SO2 ,恰好生成Na2SO3 ,计算需要NaOH溶液的体积。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省大连市高一上学期期末考试化学试卷(解析版) 题型:选择题
用NaOH固体配制一定物质的量浓度的NaOH溶液,下列操作中正确的是
A.称量时,将固体NaOH直接放在天平右盘上
B.将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解
C.定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分
D.将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中
查看答案和解析>>
科目:高中化学 来源:2016届辽宁省大连市高一上学期期末考试化学试卷(解析版) 题型:选择题
氧化还原反应在生产、生活中具有广泛的用途。下列生产、生活中的事例不包含氧化还原反应的是
A.金属锈蚀 B.海水晒盐 C.食物腐败 D.燃放鞭炮
查看答案和解析>>
科目:高中化学 来源:2016届贵州省高一上学期期中考试化学试卷(解析版) 题型:填空题
用双桥法分析下列反应,并指出氧化剂和还原剂。
(1)2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
(2)2H2 + O2 ==2H2O
查看答案和解析>>
科目:高中化学 来源:2016届福建省宁德市高一上学期期末考试化学试卷(A)(解析版) 题型:填空题
硝酸是一种强氧化性、腐蚀性的强酸,其还原产物因硝酸浓度的不同而有变化,从总体上说,硝酸浓度越高,平均每分子硝酸得到的电子数越少,浓硝酸的还原产物主要为NO2,稀硝酸的还原产物主要为NO。 实验室中,常用Cu与浓HNO3反应制取NO2,用Cu与稀HNO3反应制取NO。
(1)请写出实验室中用Cu与浓HNO3反应制取NO2的化学方程式:_____________。
(2)该反应中发生氧化反应的物质是__________,1 mol氧化剂_________(填“得到”或“失去”)_______ mol电子。
(3)48.0 g Cu与适量的浓HNO3反应,铜全部作用后,共收集到22.4 L气体(标准状况下),反应中消耗HNO3的物质的量可能是( )
A.1.5 mol B.2.0 mol C.2.5 mol D.3.0 mol
(4)实际上硝酸不仅可被还原为NO2或NO,浓度更稀时硝酸还可以被还原为N2O、N2、NH4NO3等。请将3种物质: FeSO4、Fe(NO3)3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
HNO3 + ______  ______ + ______ + N2O↑ + H2O
______ + ______ + N2O↑ + H2O
并写出配平后的离子方程式:_________________________。
(5)硝酸的还原产物NO、NO2、N2O等对环境均有副作用,为了可持续发展,当今社会提出的一个新概念——“绿色化学”,它要求从经济、环保和技术上设计可行的化学反应,则下列由单质铜制取硝酸铜的方法可行且符合“绿色化学”的是( )
A.Cu 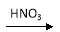 Cu(NO3)2
Cu(NO3)2
B.Cu 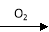 CuO
CuO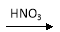 Cu(NO3)2
Cu(NO3)2
C.Cu 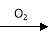 CuO
CuO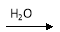 Cu(OH)2
Cu(OH)2 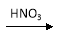 Cu(NO3)2
Cu(NO3)2
D.Cu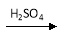 CuSO4
CuSO4 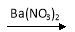 Cu(NO3)2
Cu(NO3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com