
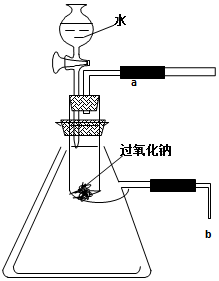
 用脱脂棉包住0.39g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.
用脱脂棉包住0.39g过氧化钠粉末,置于石棉网上,往脱脂棉上滴几滴水,可观察到脱脂棉剧烈燃烧起来.分析 (1)燃烧的条件是①物质具有可燃性,②可燃物与氧气接触,③温度达到可燃物的着火点,根据燃料燃烧的条件分析;
(2)氧气具有能使带火星的木条复燃的性质;气体具有热胀冷缩的性质,该反应放出的热量能使集气瓶内空气的压强增大,据此分析问题;
(3)过氧化钠具有强氧化性,等物质的量的过氧化钠和硫酸亚铁投入水中完全反应生成氢氧化铁和氧气,据此书写方程式.
解答 解:( 1)脱脂棉剧烈燃烧说明具备燃烧的条件,试管内空气较少,若剧烈燃烧应该有大量氧气,只有该反应是放热反应才能使燃料温度达到着火点,根据题意知该反应有氧气生成且放热,故答案为:有氧气放出;有热量放出;
(2)氧气具有使带火星的木条复燃的性质,所以可用带火星的木条靠近a处,如果木条复燃,则有氧气生成,反之无氧气生成;气体具有热胀冷缩的性质,如果该反应放热,放出的热量能使集气瓶内空气的压强增大;如果b导管插入盛水的小烧杯中,有气泡冒出,证明此反应放热;
故答案为:打开活塞(或阀门)向试管内包有过氧化钠的石棉网上滴几滴水,用带火星的木条靠近a处;带火星的木条复燃;发现b处有气泡放出;
(3)过氧化钠具有强氧化性,等物质的量的过氧化钠和硫酸亚铁投入水中完全反应生成氢氧化铁和氧气,则发生的方程式为:4FeSO4+4Na2O2+6H2O=4Fe(OH)3↓+4Na2SO4+O2↑,故答案为:4FeSO4+4Na2O2+6H2O=4Fe(OH)3↓+4Na2SO4+O2↑.
点评 本题考查了过氧化钠和水反应的实验,难度不大,解答时要从实验现象方面进行分析、判断,从而得出正确的结论,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | m-0.48 | B. | m-0.72 | C. | m-0.8 | D. | m-1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碘化亚铁溶液中滴加溴的四氯化碳溶液2Br2+2Fe2++2I-═I2+4Br-+2Fe3+ | |
| B. | 向含等物质的量浓度AgNO3和Cu(NO3)2的溶液中缓慢加入镁粉4Cu2++2Ag++5Mg═4Cu+2Ag+5Mg2+ | |
| C. | 氢氧化铁溶于氢碘酸中:2Fe(OH)3+6H++2I-═2Fe2++I2+6H2O | |
| D. | 向明矾溶液中加入Ba(OH)2溶液至生成的沉淀物质的量最多:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、Cl-、NO3- | B. | NH4+、SO42-、Na+、OH- | ||
| C. | Cu2+、Fe3+、NO3-、Cl- | D. | H+、Na+、HCO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.186 | 0.143 | 0.089 | 0.102 | 0.074 |
| 主要化合价 | +1 | +3 | +2 | +6、-2 | -2 |
| A. | 最高价氧化物对应水化物的碱性A<C | |
| B. | 氢化物的稳定性H2D<H2E | |
| C. | 单质与稀盐酸反应的速率A<B | |
| D. | C2+与A+的核外电子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
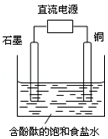 某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是( )| A. | 铜是电解池的阳极 | B. | 石墨电极附近溶液呈红色 | ||
| C. | 铜电极上产生的是无色气体 | D. | 石墨电极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔 | B. | 乙烯 | C. | 丁二烯 | D. | 丙炔 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com