
【题目】向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示.已知:2Fe2++Br2═2Fe3++2Br-2Fe3++2I-═2Fe2++I2,则下列有关说法中,不正确的是( )
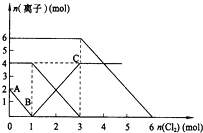
A. 还原性:I->Fe2+>Br-
B. 当通入2molCl2时,溶液中已发生的离子反应可表示为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl-
C. 原溶液中:n(Fe2+):n(I-):n(Br-)=2:1:3
D. 原混合溶液中FeBr2的物质的量为2mol
【答案】D
【解析】A项,根据氧化还原反应的强弱规律,氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物,依据已知的两个反应方程式可知,Fe2+>Br-,I->Fe2+,故还原性是:I->Fe2+>Br-,所以A正确;B项,根据氧化还原反应的先后规律,通入Cl2时,溶液中的离子将按照I-、Fe2+、Br-的顺序先后反应,再结合图像纵坐标可知,I-有2mol、Fe2+有4mol、Br-有6mol,则通入2molCl2时,2mol的I-将消耗氯气1mol,余下的1mol氯气再与2molFe2+反应,即溶液中发生的离子反应方程式为:2Fe2++2I-+2Cl2═2Fe3++I2+4Cl-,所以B正确;C项,根据B项分析可知,溶液中含有I-有2mol、Fe2+有4mol、Br-有6mol,所以n(Fe2+):n(I-):n(Br-)=2:1:3,故C正确;D项,因为溶液中含有I-有2mol、Fe2+有4mol、Br-有6mol,所以FeBr2的物质的量应为3mol,所以D错误。此题答案选D。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】(1)已知:将Cl2通入适量KOH溶液,产物中可能有KC1、KClO、KC1O3,且c(Cl-):c(ClO-)的值与温度高低有关。当n(KOH)=amol时,若某温度下,反应后c(Cl-):c(ClO-)=11,则溶液中c(ClO-):c(ClO3-)=_________________
(2)在P+CuSO4+H2O→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5molCuSO4可氧化P的物质的量为________mol。生成1molCu3P时,参加反应的P的物质的量为________mol。
(3)一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标准状况),向反应后的溶液中(存在Cu2+和SO![]() )加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 16.0g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V的极小值为________mL。
)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 16.0g,若上述气体为NO和NO2的混合物,且体积比为1∶1,则V的极小值为________mL。
(4)向一定量的Fe、FeO、Fe3O4的混合物中,加入1 mol/L 硝酸的溶液100 mL,恰好使混合物全部溶解,且放出336 mL(标准状况下)的气体,向所得溶液中加入KSCN溶液,溶液无红色出现;若取相同质量的Fe、FeO、Fe3O4的混合物,加入1 mol/L的稀硫酸溶液,也恰好使混合物完全溶解(假设还原产物唯一),反应后向所得溶液中加入KSCN溶液,溶液也无红色出现,则所加入的的稀硫酸的体积是__________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】表中评价合理的是( )
选项 | 化学反应及其离子方程式 | 评价 |
A | 铁与稀盐酸反应: | 正确 |
B | 大理石溶于醋酸的反应: | 错误,醋酸应写为分子形式CH3COOH,CaCO3应写成离子形式 |
C | 向Ba(OH)2溶液中滴加少量NaHCO3溶液:Ba2++OH﹣+HCO3﹣=BaCO3↓+H2O | 错误,方程式中Ba2+和OH﹣化学计量数之比为1:2 |
D | NH4HCO3溶液与过量KOH浓溶液共热: | 错误,HCO3﹣也可以与OH﹣反应 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水芹烯是一种具有祛痰、抗菌、杀虫作用的添加剂,由水芹烯合成聚合物H的路线如图所示。
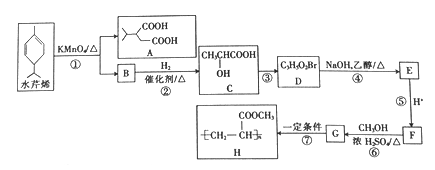
已知: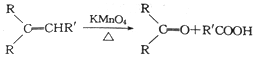
回答下列问题:
(1)B的结构简式为_______________。C的化学名称是_________________。
(2)③的反应试剂和反应条件分别是_____________,该反应的反应类型是____________。
(3)⑥的化学方程式为_____________。⑥中浓H2SO4的作用是_______________。
(4)H的分子式为_________________。
(5)M是G的同分异构体,M能与NaHCO3溶液反应生成CO2,则M可能的结构有___________种。
(6)乙酸—2—丙酯(![]() )是重要的有机化工中间体,写出以2-甲基-2-丁烯(
)是重要的有机化工中间体,写出以2-甲基-2-丁烯(![]() )为原料(其他试剂任选)制备乙酸-2-丙酯的路线:____________。
)为原料(其他试剂任选)制备乙酸-2-丙酯的路线:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某弱酸溶液中存在电离平衡HA![]() H++A-,下列叙述不正确的是
H++A-,下列叙述不正确的是
A. 溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(A-)
B. 0.10 mol/L的HA溶液中加水稀释,溶液中c(OH-)增大
C. HA溶液中加少量的NaA固体,平衡逆向移动
D. 常温下,加入NaA固体可使HA的电离常数变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】3molSO32-恰好将2molXO4-离子还原,SO32-被氧化为SO42-,则X元素在还原产物中的化合价是
A. +1 B. +2 C. +3 D. +4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于铝及含铝物质的说法正确的是
A.27Al的中子数为13
B.单质铝可用作半导体材料
C.原子半径:r(Si) >r(Al)
D.Al(OH)3能与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质的说法正确的是
A.Cu能导电,所以Cu是电解质
B.液态HCl不导电,所以HCl不是电解质
C.NH3溶于水形成的溶液能导电,所以NH3是电解质
D.BaSO4在水溶液中难导电,但熔融下能导电所以BaSO4是电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com