
| A. | 在常温常压下,20mlNH3与60mlO2所含分子个数比为1:3 | |
| B. | 在化学反应中,1mol金属镁变为镁离子时失去电子数为NA | |
| C. | 在标准状况下,1mol水的体积为22.4L | |
| D. | 2molCaCl2中Cl-的数目为2NA |
分析 A.同温同压下气体摩尔体积相同,根据n=$\frac{V}{{V}_{n}}$=$\frac{N}{{N}_{A}}$可知气体分子数与体积成正比;
B.Mg为+2价金属,1molMg转化成镁离子失去2mol电子;
C.标况下水的状态不是气体;
D.2molCaCl2中含有4mol氯离子.
解答 解:A.根据n=$\frac{V}{{V}_{n}}$=$\frac{N}{{N}_{A}}$可知,相同条件下气体分子数与体积成正比,则20mlNH3与60mlO2所含分子个数比=20mL:60mL=1:3,故A正确;
B.在化学反应中,1mol金属镁变为镁离子时失去2mol电子,失去电子数为2NA,故B错误;
C.标况下水不是气体,不能使用标况下的气体摩尔体积计算,故C错误;
D.2molCaCl2中含有4mol氯离子,含有Cl-的数目为4NA,故D错误;
故选A.
点评 本题考查了物质的量的计算,题目难度中等,明确物质的量与气体摩尔体积、阿伏伽德罗常数等之间的关系即可解答,试题有利于提高学生的化学计算能力.


科目:高中化学 来源: 题型:解答题
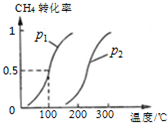 甲烷,甲醇,乙酸是化工产品的重要原料.
甲烷,甲醇,乙酸是化工产品的重要原料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔质量为44g | B. | 质量为88g/mol | ||
| C. | 有4mol氧原子 | D. | 分子数为6.02×1023 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
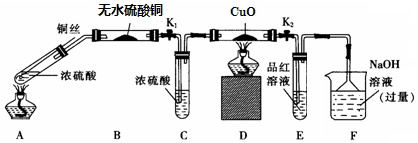
| 硫酸/mol•L-1 | 黑色物质出现的温度/℃ | 黑色物质消失的温度/℃ |
| 14 | Cu 片表面无明显现象 | |
| 15 | 约150 | 约236 |
| 16 | 约140 | 约250 |
| 18 | 约120 | 不消失 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
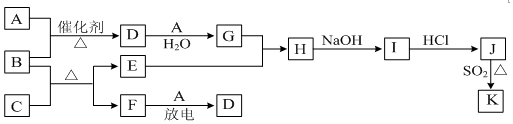
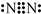
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CN-可以和稀硫酸反应生成HCN | B. | CN-可被Cl2氧化成(CN)28 | ||
| C. | 在水溶液中(CN)2可被F-还原 | D. | HCN的电子式为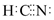 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是我校化学实验室浓盐酸试剂标签上的部分内容.
如图是我校化学实验室浓盐酸试剂标签上的部分内容.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com