
【题目】下列有关烃类物质的说法正确的是( )
A. 石油通过减压分馏可以得到相对分子量较大的芳香烃
B. 丙烯与溴的四氯化碳溶液反应生成1,3-二溴丙烷
C. ![]() 中至少有16个原子共平面
中至少有16个原子共平面
D. ![]() 的一氯代物的同分异构体有12种
的一氯代物的同分异构体有12种
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案科目:高中化学 来源: 题型:
【题目】氮氧化合物和二氧化硫是引起雾霾的重要物质,工业用多种方法来治理。某种综合处理含 NH4+废水和工业废气(主要含 NO、CO、CO2、SO2、N2)的流程如图:

已知:NO+NO2+2NaOH=2NaNO2+H2O 2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)固体 1 的主要成分有 Ca(OH)2、___________________、__________________(填化学式)。
(2)若实验室需要配制100mL 3.00mol·L-1NaOH溶液进行模拟测试,需用托盘天平称取 NaOH固体质量为______g。
(3)用 NaNO2 溶液处理含NH4+废水反应的离子方程式为_______________________。
(4)捕获剂从气体 3 中捕获的气体主要是__________________ (填化学式)。
(5)流程中生成的 NaNO2 因外观和食盐相似,又有咸味,容易使人误食中毒。已知 NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O;I2 可以使淀粉变蓝。根据上述反应, 选择生活中常见的物质和有关试剂进行实验,以鉴别 NaNO2 和 NaCl。需选用的物质是_____________________(填序号)。
①水 ②淀粉碘化钾试纸 ③淀粉 ④白酒 ⑤白醋
A.①③⑤ B.①②④ C.①②⑤ D.①②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g)→2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应_____(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是____。用O2表示0~1s内该反应的平均速率v=____。

(3)能说明该反应已达到平衡状态的是____(填字母)。
a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对甲基苯乙烯(![]() )是有机合成的重要原料。下列对其结构与性质的推错误的是( )
)是有机合成的重要原料。下列对其结构与性质的推错误的是( )
A. 分子式为![]()
B. 能发生加聚反应和氧化反应
C. 具有相同官能团的芳香烃同分异构体有5种![]() 不考虑立体异构
不考虑立体异构![]()
D. 分子中所有原子可能处于同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向AgCl浊液中滴加氨水后可得到澄清溶液,继续滴加浓硝酸后又有沉淀生成。经查资料得知:Ag++2NH3·H2O![]() Ag(NH3)2++2H2O,平衡常数记为K[Ag(NH3)2+],下列分析不正确的是( )
Ag(NH3)2++2H2O,平衡常数记为K[Ag(NH3)2+],下列分析不正确的是( )
A. 浊液中存在沉淀溶解平衡:AgCl(s)![]() Ag+(aq)+Cl-(aq)
Ag+(aq)+Cl-(aq)
B. 实验表明实验室可用氨水洗涤附着有银的试管
C. 由实验可以判断K[Ag(NH3)2+]>KSP(AgCl)
D. 由资料信息可推知:加浓硝酸后生成的沉淀为AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是石蜡油在炽热碎瓷片的作用下分解产生某种气体,并验证其性质的装置:

回答下列问题:
(1)该气体可以衡量一个国家的石油化工生产水平,该气体的结构简式是___________。发生聚合反应的化学方程式_____________________________________。
(2)B中酸性高锰酸钾溶液和C中溴的四氯化碳溶液都褪色,说明该气体能被酸性高锰酸钾______。在C中发生的化学反应方程式为______________,反应类型为_________。
(3)该气体通过一系列反应可以得到乙炔,写出实验室制取乙炔的化学方程式:______________________________________。
(4)由乙炔可以制取甲苯,甲苯一溴代物的同分异构体有________种,其中对溴甲苯的结构简式为__________________。
(5)甲苯可用于制造烈性炸药TNT,该反应的化学方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z(均为气体)三种物质的量随时间的变化曲线如图所示:

(1)由图中所给数据进行分析,该反应的化学方程式为__________。
(2)若上述反应中X、Y、Z分别为H2、N2、NH3,某温度下,在容积恒定为2.0L的密闭容器中充入2.0mol N2和2.0mol H2,一段时间后反应达平衡状态,实验数据如表所示:
t/s | 0 | 50 | 150 | 250 | 350 |
n(NH3) | 0 | 0.24 | 0.36 | 0.40 | 0.40 |
0~50s内的平均反应速率v(N2)=_________。
(3)已知:键能指在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量,用符号E表示,单位为kJ/mol。![]() 的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1mol NH3过程中___(填“吸收”或“放出”)的能量为____,反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
的键能为946kJ/mol,H-H的键能为436kJ/mol,N-H的键能为391kJ/mol,则生成1mol NH3过程中___(填“吸收”或“放出”)的能量为____,反应达到(2)中的平衡状态时,对应的能量变化的数值为____kJ。
(4)为加快反应速率,可以采取的措施是_______
a.降低温度
b.增大压强
c.恒容时充入He气
d.恒压时充入He气
e.及时分离NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述不正确的是( )
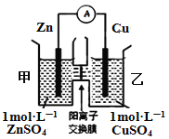
A. Zn电极上发生氧化反应
B. 电池工作后,甲池的SO42-微粒数减少
C. 电池工作后,甲池溶液的阳离子移动到乙池
D. 电池工作后,乙池中的Cu电极质量增加
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T时,向4.0 L恒容密闭容器中充入2.0 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法正确的是
A. 反应在前50 s的平均速率为v(PCl3)=0.006 4 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入4.0 mol PCl3、4.0 mol Cl2,达到平衡时,则此反应的化学平衡常数为1/40
D. 相同温度下,起始时向容器中充入2.0 mol PCl5、0.40 mol PCl3和0.40 mol Cl2,达到平衡前v(正)<v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com