
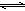 NH3·H2O+H+
NH3·H2O+H+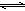 2NH3(g) ΔH=-92.2 kJ·mol-1。
2NH3(g) ΔH=-92.2 kJ·mol-1。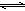 NH3·H2O+H+。
NH3·H2O+H+。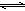 2NH3(g) ΔH=-92.2 kJ·mol-1。
2NH3(g) ΔH=-92.2 kJ·mol-1。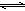 2SO3,反应过程中剩余O2为:0.21 mol×10L=2.1 mol,参加反应的氧气的物质的量为:3 mol-2.1 mol=0.9 mol;根据方程式可以得出,反应消耗的SO2为0.9 mol×2=1.8 mol,故SO2的转化率为:1.8mol/2mol="0.90" (90%)。
2SO3,反应过程中剩余O2为:0.21 mol×10L=2.1 mol,参加反应的氧气的物质的量为:3 mol-2.1 mol=0.9 mol;根据方程式可以得出,反应消耗的SO2为0.9 mol×2=1.8 mol,故SO2的转化率为:1.8mol/2mol="0.90" (90%)。

 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源:不详 题型:单选题
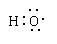 组成元素相同,含有相同的电子数
组成元素相同,含有相同的电子数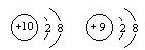 的两种粒子为同一种元素
的两种粒子为同一种元素查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na、Mg、Al的第一电离能逐渐增大 |
| B.HI、HBr、HCl、HF的稳定性依次降低 |
| C.N、O、S的非金属性逐渐增强 |
| D.O、F、H的原子半径依次减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
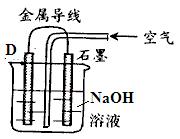
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.在化学反应中某元素由化合态变为游离态,该元素一定是被还原 |
| B.失电子难的原子获得电子的能力一定强 |
| C.电子层结构相同的各种离子,它的半径随核电荷数的增加而减少 |
| D.最外层电子数少的金属元素,一定比最外层电子数较它多的金属元素活泼性较强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com