
| ||
| ||


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 0.01mol?L-1的溶液 | X | Y | Z | W |
| PH | 12 | 2 | 8.5 | 4.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
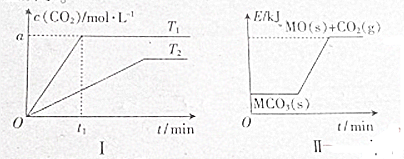
| A、图象Ⅰ中的温度:T1<T2 |
| B、T2时缩小容积’重新达到平衡时c(CO2)增大 |
| C、T1时该反应的平衡常数K=a |
| D、T1和T2温度下平衡常数:K1<K2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 条件 | 离子组 | 离子共存判断及反应的离子方程式 |
| A | 滴加氨水 | Na+、Al3+、Cl-、 NO3- | 不能大量共存,Al3++3OH-═Al(OH)3↓ |
| B | 由水电离出的H+浓度为1×10-12mol?L-1 | NH4+、Na+、NO3-、Cl- | 一定能大量共存,NH4++H2O?NH3?H2O+H+ |
| C | pH=1的溶液 | Fe2+、Al3+、SO42-、MnO4- | 不能大量共存,5Fe2++MnO4-+8H+═Mn2++5Fe3++4H2O |
| D | 通入少量的SO2气体 | K+、Na+、ClO-、SO42- | 不能大量共存,2ClO-+SO2+H2O═2HClO+SO32- |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
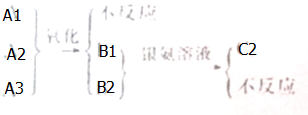 有三个只含C、H、O的有机化合物Al、A2、A3,它们互为同分异构体.室温时A1为气态,A2、A3是液态.分子中C与H的质量分数是73.3%.在催化剂(Cu、Ag等)存在下,A1不起反应.A2、A3分别氧化得到B2、B3.B2可以被硝酸根的氨水溶液氧化得到C2,而B3则不能.上述关系也可以表示如图.
有三个只含C、H、O的有机化合物Al、A2、A3,它们互为同分异构体.室温时A1为气态,A2、A3是液态.分子中C与H的质量分数是73.3%.在催化剂(Cu、Ag等)存在下,A1不起反应.A2、A3分别氧化得到B2、B3.B2可以被硝酸根的氨水溶液氧化得到C2,而B3则不能.上述关系也可以表示如图.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com