
【题目】G是药物中间体,其部分合成路线如下:

已知:RCHO+CH3COR1![]() RCH=CHOR1+H2O
RCH=CHOR1+H2O
请回答下列问题:
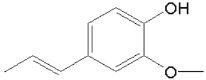
⑴D所含官能团有醚键、羟基和________。试剂E的名称是________。
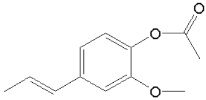
⑵C→D的反应类型为________。G的分子式为________。
⑶写出A→B的化学方程式________。
⑷在上述方案中,设计A→B、C→D步骤的目的是________。
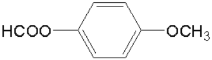
⑸芳香族化合物T是D的同分异构体,T同时具备下列条件的结构有________种。
①能发生银镜反应;
②遇FeCl3溶液不发生显色反应,但其在稀硫酸中水解的产物之一遇FeCl3溶液能发生显色反应。其中,在核磁共振氢谱上有4组峰的T的结构简式为________。
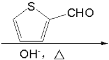
⑹以环己醇和 为原料,设计合成
为原料,设计合成 路线
路线![]() 无机试剂自选
无机试剂自选![]() :________。
:________。
【答案】醛基 丙酮 水解![]() 或取代
或取代![]() 反应
反应 ![]()
![]()
![]() 保护羟基
保护羟基![]() 或酚羟基
或酚羟基![]()
![]()
![]()
![]()
![]()
![]()
【解析】
⑴根据D的结构简式得出D的官能团,根据信息中羟醛缩合的反应特征,结合D、F的结构简式对比可知E结构简式。
⑵C含有酯基,根据前后联系得出反应类型,根据G的结构简式可知G的分子式。
⑶结合A、B结构简式可知A→B的反应时乙酸酐与酚羟基发生取代反应,写出方程式。
⑷根据A→B,C→D,结合B→C是氧化反应,得出目的。
⑸根据信息得出T能发生银镜反应,遇FeCl3溶液不发生显色反应,但其在稀硫酸中水解的产物之一遇FeCl3溶液能发生显色反应,说明含有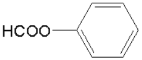 结构且不含酚羟基,结合D的分子式为C8H8O3,所以T含两个取代基:第一组是HCOO—、—CH2OH;第二组是HCOO—、—OCH3,在根据同分异构体书写规则得出。
结构且不含酚羟基,结合D的分子式为C8H8O3,所以T含两个取代基:第一组是HCOO—、—CH2OH;第二组是HCOO—、—OCH3,在根据同分异构体书写规则得出。
⑹分析目标产物和原料,结合已知信息羟醛缩合可知,将环己醇氧化为环己酮,再与发生羟醛缩合反应,最后将酮重新还原为醇即可。
⑴由D的结构简式可知D所含官能团有醚键、羟基和醛基;根据信息中羟醛缩合的反应特征,结合D、F的结构简式对比可知,E为丙酮CH3COCH3,故答案为:醛基;丙酮。
⑵C含有酯基,在酸性条件下发生水解反应生成D,水解反应属于取代反应;由G的结构简式可知G的分子式为:C19H20O5;故答案为:水解![]() 或取代
或取代![]() 反应;C19H20O5。
反应;C19H20O5。
⑶结合A、B结构简式可知A→B的反应时乙酸酐与酚羟基发生取代反应,反应的副产物是CH3COOH,则反应方程式为:
![]()
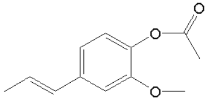
![]() ;故答案为:
;故答案为:
![]()

![]() 。
。
⑷A→B将羟基变成酯基,C→D将酯基变成羟基,结合B→C是氧化反应,则设计A→B、C→D步骤的目的是避免酚羟基被氧化,其目的是保护羟基;故答案为:保护羟基![]() 或酚羟基。
或酚羟基。
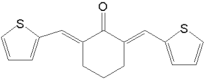
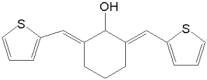
⑸依题意,T能发生银镜反应,遇FeCl3溶液不发生显色反应,但其在稀硫酸中水解的产物之一遇FeCl3溶液能发生显色反应,说明含有 结构且不含酚羟基,结合D的分子式为C8H8O3,所以T含两个取代基:第一组是HCOO—、—CH2OH;第二组是HCOO—、—OCH3,所以,符合条件的同分异构体有6种;其中,
结构且不含酚羟基,结合D的分子式为C8H8O3,所以T含两个取代基:第一组是HCOO—、—CH2OH;第二组是HCOO—、—OCH3,所以,符合条件的同分异构体有6种;其中,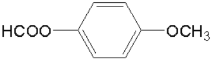 在核磁共振氢谱上有4组峰。故答案为:6;
在核磁共振氢谱上有4组峰。故答案为:6; 。
。
⑹分析目标产物和原料,结合已知信息羟醛缩合可知,将环己醇氧化为环己酮,再与发生羟醛缩合反应,最后将酮重新还原为醇即可,则合成路线为:![]()
![]()
![]()
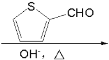
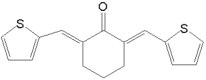
![]()
 。故答案为:
。故答案为:![]()
![]()
![]()


![]()
 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. H2(g)+I2(g) ![]() 2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变
2HI(g),其他条件不变,缩小反应容器体积,正逆反应速率不变
B. 若压强不再随时间变化能说明反应A(?)+B(g)![]() 2C(?)已达平衡,则A、C不能同时是气体
2C(?)已达平衡,则A、C不能同时是气体
C. C(s)+H2O(g) ![]() H2(g)+CO,碳的质量不再改变不能说明反应已达平衡
H2(g)+CO,碳的质量不再改变不能说明反应已达平衡
D. 2NO2 ![]() N2O4(无色),体系颜色不再变化说明反应已达平衡,反应停止
N2O4(无色),体系颜色不再变化说明反应已达平衡,反应停止
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系不正确的是( )
A.沸点:戊烷>2-甲基丁烷>2,2—二甲基丙烷>丙烷
B.密度:CCl4>CHCl3>H2O>苯
C.同分异构体数目:C5H12>C5H10>C4H10>C4H8>C3H8
D.等物质的量燃烧耗O2量:C5H12>C5H10>C4H10>C4H8>C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在密闭容器中进行下列反应:M(g) + N(g)![]() R(g) + 2L(?),此反应规律符合下图图像。
R(g) + 2L(?),此反应规律符合下图图像。

①T1______T2 ,正反应的△H______0。(填“>”、“<”或“=”,下同)。
②P1________P2, L为_______。(填“固”或“液”或“气”态)。
(2)合成氨的原理为:N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)![]() H=-92.4 kJ/mol,该反应的能量变化如图所示。
H=-92.4 kJ/mol,该反应的能量变化如图所示。
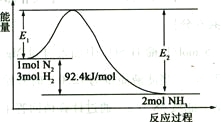
①在反应体系中加入催化剂,反应速率增大,E2的变化是_______(填“增大”、“减小”或“不变”)。②若在一密闭容器中加入1molN2和3molH2,在一定条件下充分反应,放出的热量____92.4kJ.(填“>”、“<”或“=”)。
③将1 mol N2和3 mol H2充入体积不变的密闭容器中,在一定条件下达到平衡,此时欲提高该容器中H2的转化率,下列措施可行的是_________(填字母)。
A.向容器中按原比例再充入原料气 | B.向容器中再充入一定量H2 |
C.改变反应的催化剂 | D.液化生成物分离出氨 |
④若在密闭容器中充入2molN2和6molH2反应达平衡时N2的转化率为40%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率分别为_____________mol、_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,相同浓度的两种一元酸HX、HY分别用同一浓度的NaOH标准溶液滴定,滴定曲线如图所示。下列说法正确的是![]()
![]()
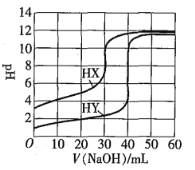
A.HX、HY起始溶液体积相同
B.均可用甲基橙作滴定指示剂
C.pH相同的两种酸溶液中:![]()
D.同浓度KX与HX的混合溶液中,粒子浓度间存在关系式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na+浓度为1.0mol/L的某澄清溶液中,还可能含有K+,Mg2+,Fe3+,Ba2+,Cl-,CO32-,SO32-,SiO32-,SO42-等离子,取该溶液100ml进行下图连续实验(所加试剂均过量,气体全部逸出)。下列说法不正确的是
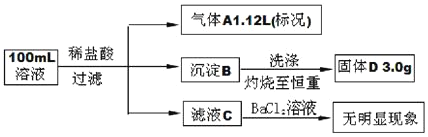
A.原溶液中一定不存在Mg2+,Fe3+,Ba2+,SO42-
B.在100ml原溶液中加入足量BaCl2溶液,至少可生成沉淀20.5g
C.为确定原溶液中是否含有Cl-,可取滤液C,加入AgNO3和稀HNO3溶液
D.原溶液一定存在K+,c(K+)可能为1.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《自然》杂志曾报道我国科学家通过测量SiO2中26Al和10Be两种元素的比例确定“北京人”年龄的研究结果,这种测量方法叫“铝铍测年法” 。完成下列填空:
(l)l0Be和9Be_______。
a.是同一种原子 b.具有相同的中子数
d.具有相同的化学性质 d.互为同位素
⑵写出A1与NaOH溶液反应的化学方程式:___________________________。
(3)研究表明28A1可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是__________。
a.比较Mg (OH) 2与A1 (OH) 3的碱性强弱
b.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液
c.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的单质的硬度和熔点
(4)目前还有一种测量方法叫“钾氩测年法”。写出和Ar核外电子排布相同的常见阴离子的半径由大到小的顺序:_______(用化学符号表示);其中一种离子与钾同周期相邻元素的离子所形成的化合物可用作干燥剂,用电子式表示该物质的形成过程__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)212H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料—铝灰(含 Al、Al2O3 及少量 SiO2 和 FeOxFe2O3)可制备明矾。工艺流程如下:

回答下列问题:
(1)欲配制 480 ml 1.0 mol / L H2SO4 溶液,需要 18 mol / L H2SO4 溶液的体积是 __,已有下列仪器:烧杯,量筒,胶头滴管,玻璃棒,还需用到的仪器是 ______。
(2)明矾净水的原理是 ________(用离子方程式表示)。
(3)检验滤液 A 中是否存在 Fe2+ 的实验操作是 ________。
(4)在滤液 A 中加入高锰酸钾溶液的目的是 ______(用离子方程式表示)(该条件下 MnO4- 转化为 Mn2+)
(5)已知:加入 MnSO4,Mn2+ 可与 MnO4- 反应生成 MnO2,该反应氧化剂与还原剂的物质的量之比为 ____。
(6)操作Ⅱ是 _____、______、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知293K时下列物质的溶度积![]() 单位已省略
单位已省略![]() :
:
| Ag2SO4 | FeS | CuS | Ag2S |
| 1.2×10-5 | 6.3×10-18 | 8.5×10-45 | 6.3×10-50 |
下列说法正确的是![]()
![]()
A.相同温度下,Ag2SO4、FeS、CuS饱和溶液中:![]()
B.向FeS悬浊液中滴加CuSO4溶液发生反应的离子方程式:![]()
C.浓度均为0.004mol/L的AgNO3和H2SO4溶液等体积混合后不能产生沉淀
D.向饱和Ag2S溶液中加少量Na2S固体,溶液中c(Ag+)不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com