
对于可逆反应:mA(g)+nB(g)  xC(g) ΔH,在不同温度及压强(P1、P2)条件下,反应物A的转化率如图所示,下列判断正确的是
xC(g) ΔH,在不同温度及压强(P1、P2)条件下,反应物A的转化率如图所示,下列判断正确的是
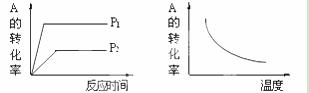
A.ΔH<0,m+n>x B.ΔH>0,m+n<x
C.ΔH<0,m+n<x D.ΔH>0,m+n>x
科目:高中化学 来源: 题型:
下列说法中正确的是
A.乙炔分子中,每个碳原子都有两个未杂化的2p轨道形成π键
B.sp3杂化轨道是由能量相近1个s轨道和3个p轨道混合形成的四个sp3杂化轨道
C.凡中心原子采取sp2杂化的分子,其分子构型都是平面三角形
D.氨气分子中有一对未参与杂化的孤对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列哪种说法可以证明反应.N2+3H2 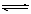 2NH3已达到平衡状态 ( )
2NH3已达到平衡状态 ( )
A.1个N≡N键断裂的同时,有3个H—H键形成
B.1个N≡N键断裂的同时,有3个H—H键断裂
C.1个N≡N键断裂的同时,有2个N—H键断裂
D.1个N≡N键断裂的同时,有6个N—H键形成
查看答案和解析>>
科目:高中化学 来源: 题型:
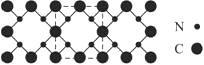
氮化碳结构如下图,其中β-氮化碳硬度超过金刚石晶体,成为首屈一指的超硬新材料。下列有关氮化碳的说法不正确的是
A.氮化碳属于原子晶体
B.氮化碳中碳显—4价,氮显+3价
C.氮化碳的化学式为:C3N4
D.每个碳原子与四个氮原子相连,每个氮原子与三个碳原子相连
查看答案和解析>>
科目:高中化学 来源: 题型:
为探究锌与稀硫酸的反应速率[以v(H2)表示],向反应混合物中加入某些物质,下列判断不正确的是
A.加入少量NaCl固体,v(H2)不变 B.加入少量水,v(H2)减小
C.加入少量CH3COONa固体,v(H2)不变 D.加入少量CuSO4溶液,v(H2)变大
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,体积均为0. 25L的两个恒容密闭容器中发生可逆反应:N2 (g)+3H2 (g)  2NH3 (g)
2NH3 (g)
△H= - 92. 6kJ/moL。实验测得起始、平衡时的有关数据如下表:
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系 能量的变化 | ||
| N2 | H2 | NH3 | ||
| ① | 1 | 3 | 0 | 放出热量:23.15kJ |
| ② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是
A.容器②中达平衡时放出的热量Q=23. 15kJ
B.平衡时,两个容器中NH3的体积分数均为1/7
C.容器①、②中反应的平衡常数相等
D.若容器①体积为0. 5L,则平衡时放出的热量小于23. 15kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
下列描述,其因果关系成立的是( )
A.因为NH3的水溶液可以导电,所以NH3是电解质
B.因为Cl2可以使湿润的有色布条褪色,所以Cl2具有漂白性
C.因为液态HCl不导电,所以HCl是非电解质
D.因为氢氧化铁胶体具有吸附性,所以常用于净水
查看答案和解析>>
科目:高中化学 来源: 题型:
在无土裁培中,配制1L内含0.5mol NH4Cl、0.16mol KCl、0.24mol K2SO4的某营养液,若用KCl、NH4Cl和(NH4)2SO4三种固体配制,则需此三种固体的物质的量分别为:( )
A.0.64mol 0.02mol 0.24mol B.0.66mol 0.50mol 0.24mol
C.0.64mol 0.50mol 0.24mol D.0.40mol 0.50mol 0.12mol
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液仅含Fe2+、Na+、Al3+、Ba2+、SO42-、NO3-、Cl-中的4种离子,所含离子的物质的量均为1mol。若向该溶液中加入少量的稀硫酸,有气泡产生,且溶液中阴离子种类不变(不考虑水的电离和离子的水解)。下列说法不正确的是
A.若向该溶液中加入足量的NaOH溶液,充分反应后,过滤、洗涤、灼烧,最终所得固体的质量为72g
B.若向该溶液中加入过量的稀硫酸,溶液中阴离子种类仍不变
C.若向该溶液中加人过量的稀硫酸和KSCN溶液,溶液出现血红色
D.该溶液中一定不含Al3+、Ba2+、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com