
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
分析 分子式为C4H10O的有机物,分子中含有-OH,该有机物为丁醇,先书写丁基-C4H9异构,丁基异构数目等于丁醇的异构体数目,据此进行解答.
解答 解:分子式为C4H10O的有机物,含有-OH则一定属于饱和一元醇,
丁基-C4H9可能的结构有:-CH2CH2CH2CH3、-CH(CH3)CH2CH3、-CH2CH(CH3)2、-C(CH3)3,丁基异构数目等于丁醇的异构体数目,则丁醇的可能结构有4种,分别为:CH3CH2CH2CH2OH、CH3CH2CH(CH3)OH、(CH3)2CHCH2OH、C(CH3)3OH,
故选D.
点评 本题考查有机物的推断、同分异构体的书写等,难度中等,利用烃基异构判断,比书写丁醇的同分异构体简单容易.


科目:高中化学 来源: 题型:选择题
| A. | 一般具有良好的绝缘性 | |
| B. | 一般比同质量金属强度大 | |
| C. | 均不溶于水,易溶于有机溶剂 | |
| D. | 有的高分子材料具有耐化学腐蚀、耐热、耐磨、耐油、不透水等特点 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 晶体根据结构和性质只可分为分子晶体、原子晶体、离子晶体和金属晶体四大类 | |
| B. | 任何晶体中都含有化学键,如离子键、共价键、金属键、氢键等 | |
| C. | 含有阳离子的晶体一定是离子晶体 | |
| D. | 干冰和冰都属于分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
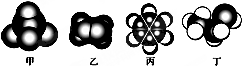
| A. | 甲的二氯代物只有一种 | |
| B. | 乙能与溴水发生取代反应而使溴水褪色 | |
| C. | 1mol丙中含有碳碳双键的数目是3NA | |
| D. | 丁在稀硫酸作用下可与甲酸发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
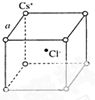 根据已学知识,请你回答下列问题:
根据已学知识,请你回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
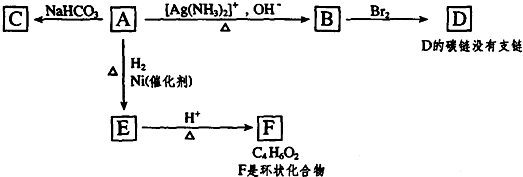
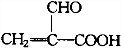 .
.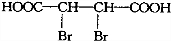 .
.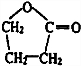 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com