
H2A为二元弱酸,则下列说法正确的是( )
A.在溶质物质的量相等的Na2A、NaHA两溶液中,阴离子总数相等
B.在等物质的量浓度的Na2A、NaHA两溶液中,前者pH大于后者
C.在NaHA溶液中一定有:c(Na+)>c(HA-)>c(OH-)>c(H+)
D.在Na2A溶液中一定有:c(Na+)+c(H+)=c(HA-)+c(OH-)+c(A2-)
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
将硬脂酸甘油酯与NaOH溶液共热进行皂化反应,能把硬脂酸钠和甘油从混合物中分离出来的操作有:①盐析;②过滤;③蒸馏;④分液。其中正确的组合是( )
A.①②③ B.①③④ C.②③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
已知空气-锌电池的电极反应:锌片:Zn-2OH--2e- = ZnO + H2O,
石墨:1/2 O2+H2O +2e- = 2OH-,据次推断锌片是
A.负极,被氧化 B.负极,被还原 C.正极,被氧化 D.正极,被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)常温下将0.2mol/L HCl溶液与0.2mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
①混合溶液中由水电离出的c(H+) 0.2mol/LHCl溶液中由水电离出的c(H+);
(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):c(Cl-)-c(M+)= mol/L。
(2)常温下若将0.2mol/L MOH溶液与0.1mol/L HCl溶液等体积混合,测得混合溶液的pH<7,则说明在相同条件下MOH的电离程度 MCl的水解程度。
(填“>”、“<”、或“=”)
(3)常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH 。(填“>7”、“<7”、或“无法确定”)
(4)用0.1032mol/L HCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下所示
| 实验序号 | 0.1032mol/L HCl溶液体积/mL | 待测NaOH溶液体积/mL |
| 1 | 27.83 | 25.00 |
| 2 | 26.53 | 25.00 |
| 3 | 27.85 | 25.00 |
①待测NaOH溶液的物质的量浓度为 mol/L。(保留四位有效数字)
②下列情况可能引起测定结果偏高的是 。
A.酸式滴定管未用标准盐酸溶液润洗
B.锥形瓶未用待测液润洗
C.滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D.滴定前,滴定管中的溶液液面最低点在“0”点以下
(5)滴定的方法有酸碱中和滴定、沉淀滴定、络合滴定等。沉淀滴定所用的指示剂本身就是一种沉淀剂。已知一些银盐的颜色和Ksp(20℃)如下,测定水体中氯化物的含量,常用标准硝酸银溶液进行滴定。
| 化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
| 颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
| Ksp | 1.8×10-10 | 5.0×10-13 | 8.3×10-17 | 2.0×10-48 | 1.8×10-10 |
滴定时,你认为该滴定适宜选用的指示剂是下列中的 。
A. KBr B. KI C. K2S D. K2CrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验过程中,始终无明显现象的是( )
A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中 D.SO2通入已酸化的Ba(NO3)2溶液中
查看答案和解析>>
科目:高中化学 来源: 题型:
已知氧化性Fe3+>I2。向Fe I 2溶液中通入一定量的Cl2,发生反应的离子方程式为: a Fe2++b I-+c Cl2→d Fe3++ e I2+ f Cl- 。下列选项中的数字与离子方程式中的a、b、c、d、e、f一一对应,其中不符合反应实际的是 ( )
A.2,4,3,2,2,6 B. 0,2,1,0,1,2
C.2,0,1,2,0,2 D. 2,8,5,2,4,10
查看答案和解析>>
科目:高中化学 来源: 题型:
部分中学化学常见元素原子结构及性质如表所示:
| 序号 | 元素 | 结构及性质 |
| A | A单质是生活中常见金属,它有两种氯化物,相对分子质量相差35.5 | |
| B | B原子最外层电子数是内层电子总数的1/5 | |
| ③ | C | C是常见化肥的主要元素,单质常温下呈气态 |
| ④ | D | D单质被誉为“信息革命的催化剂”,是常用的半导体材料 |
| ① | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 |
| ② | F | F在周期表中可以排在ⅠA族,也有人提出排在ⅦA族 |
23.A元素在周期表中的位置为____________________________________________。
24.B与C形成的化合物的化学式为________,它属于________(填“离子”或“共价”)化合物。
25.①F与E可以形成原子个数比分别为2∶1、1∶1的两种化合物X和Y,区别X与Y的水溶液的实验方法是___________________________________________________
________________________________________________________________________。
②F与C组成的两种化合物M和N所含的电子数分别与X、Y相等,则M的水溶液显________性,N的结构式为________。
26.C与E都是较活泼的非金属元素,用化学方程式表明这两种单质的氧化性强弱
________________________________________________________________________。
27.有人认为B、D的单质用导线连接后插入氯化钠溶液中可以形成原电池,你认为是否可以,若可以,试写出正极的电极方程式(若认为不行可不写)___________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上制备BaCl2的工艺流程图如下:
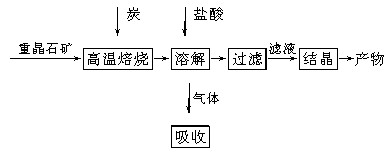
某研究小组在实验室用重晶石(主要成分为BaSO4)对工业过程进行模拟实验。查表得:
BaSO4(s)+4C(s)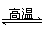
 4CO(g)+BaS(s)
4CO(g)+BaS(s)
ΔH1=571.2 kJ·mol-1 ①
BaSO4(s)+2C(s)
 2CO2(g)+BaS(s)
2CO2(g)+BaS(s)
ΔH2=226.2 kJ·mol-1 ②
(1)气体用过量NaOH溶液吸收,得到硫化钠。Na2S水解的离子方程式为________________________________________________________________________
________________________________________________________________________。
(2)向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,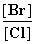 =__________________。
=__________________。
[Ksp(AgBr)=5.4×10-13 mol2·L-2,Ksp(AgCl)=2.0×10-10 mol2·L-2]
(3)反应:C(s)+CO2(g)
 2CO(g)的ΔH=________kJ·mol-1。
2CO(g)的ΔH=________kJ·mol-1。
(4)实际生产中必须加入过量的炭,同时还要通入空气,其目的是
________________________________________________________________________,
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com