
| A. | Fe3O4 | B. | FeO | C. | Fe2O3 | D. | Fe5O7 |
分析 由生成的CO2全部通入足量澄清石灰水中,得到7.0g沉淀,则n(CaCO3)=$\frac{7.0g}{100g/mol}$=0.07mol,由CO~CO2可知,铁的氧化物中的n(O)=0.07mol,再计算Fe的物质的量,可确定化学式,以此来解答.
解答 解:由生成的CO2全部通入足量澄清石灰水中,得到7.0g沉淀,则n(CaCO3)=$\frac{7.0g}{100g/mol}$=0.07mol,由CO~CO2可知,铁的氧化物中的n(O)=0.07mol,n(Fe)=$\frac{3.92g-0.07mol×16g/mol}{56g/mol}$=0.05mol,
n(Fe):n(O)=0.05mol:0.07mol=5:7,
则铁的氧化物为Fe5O7,
故选D.
点评 本题考查氧化还原反应的计算,为高频考点,把握铁的氧化物中O原子物质的量计算为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案科目:高中化学 来源: 题型:选择题

| A. | 甲装置工作过程中pH增大 | |
| B. | 乙装置中石墨电极反应式为C-4e-+2O2-═CO2↑ | |
| C. | 甲装置中通入O2的电极反应式为:O2+4e-+4H+═2H2O | |
| D. | 若不考虑装置的损失,制备24.0g金属钛,需要消耗氢气22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| X | 578 | 1817 | 2745 | 11578 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 496 | 4562 | 6912 | 9543 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
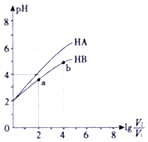 在25℃下,稀释HA、HB两种酸溶液,浓液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积,下列说法不正确的是( )
在25℃下,稀释HA、HB两种酸溶液,浓液pH变化的曲线如图所示,其中V1表示稀释前酸的体积,V2表示稀释后溶液的体积,下列说法不正确的是( )| A. | a、b两点水的电离程度a小于b | |
| B. | HA、HB两种酸溶液pH相同时,c(HA)<c(HB) | |
| C. | 曲线上a、b两点$\frac{c({B}^{-})}{c(HB)•(O{H}^{-})}$一定相等 | |
| D. | 25℃时,NaA溶液中c(A-)一定大于NaB溶液中c(B-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1molHCl气体 | B. | 0.1molNa2SO4固体 | ||
| C. | 0.2molNaOH固体 | D. | 0.1mol葡萄糖晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式符合C4H8的同分异构体有4种 | |
| B. | 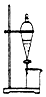 用如图所示装置完成用水除去硬脂酸钠中的甘油 | |
| C. | 乙醇的沸点高于丙烷,氨气的沸点高于磷化氢,都是因为分子间存在氢键 | |
| D. | 苯酚有毒,对皮肤有腐蚀性,若不慎沾到皮肤上,应立即用水洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如图所示,下列说法正确的是( )
常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如图所示,下列说法正确的是( )| A. | 向HB溶液中滴加NaOH溶液的过程中,水的电离程度一直增大 | |
| B. | 用pH为11的某碱与pH为3的HB溶液等体积混合后,溶液不可能显碱性 | |
| C. | 氨水与HA溶液混合后的溶液中可能存在:c(NH4+)>c(A-)>c(H+)>c(OH-) | |
| D. | 完全中和等体积等pH的HA、HB两溶液时,消耗同浓度NaOH溶液的体积:HA<HB |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com