
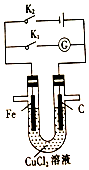
| A. | 同时打开K1、K2,铁棒上有紫红色物质析出 | |
| B. | 只闭合K1,石墨棒上有紫红色物质析出 | |
| C. | 只闭合K2,当电路中通过0.3mol电子时,两极共产生4.48L(标准状况)气体 | |
| D. | 只闭合K2,一段时间后,将电解质溶液搅拌均匀,溶液的pH变大(不考虑Cl2的溶解) |
分析 若闭合K1,该装置没有外接电源,所以构成了原电池;组成原电池时,较活泼的金属铁作负极,负极上铁失电子发生氧化反应;石墨棒作正极,正极上铜离子得电子发生还原反应生成铜单质;若闭合K2,该装置有外接电源,所以构成了电解池,Fe与负极相连为阴极,阴极先是铜离子放电生成铜单质,然后是氢离子放电产生氢气,碳棒与正极相连为阳极,阳极先是氯离子放电产生氯气,然后是氢氧根放电产生氧气,据此解答.
解答 解:A.同时打开K1、K2,不能形成闭合回路,铁与铜离子直接发生氧化还原反应生成亚铁离子和铜单质,铁棒上有紫红色物质析出,故A正确;
B.闭合K1,构成了原电池,石墨棒作正极,正极上铜离子得电子发生还原反应生成铜单质,石墨棒上有紫红色物质析出,故B正确;
C.K2闭合,Fe与负极相连为阴极,反应为Cu2++2e-=Cu、2H++2e-=H2↑,碳棒与正极相连为阳极,反应为2Cl--2e-=Cl2↑、4OH--4e-=2H2O+O2↑,1L 0.lmol/L氯化铜溶液中铜离子物质的量为0.1mol,氯离子物质的量为0.2mol,0.1mol Cu2+转移电子0.2mol,0.2mol Cl-转移电子0.2mol,整个电路中通过0.3mol电子时,阴极氢离子还应得电子0.1mol,产生氢气0.05mol,阳极氢氧根失电子0.1mol,产生氧气0.025mol,两极共产生0.075mol气体,在标况下的体积为0.075mol×22.4L/mol=1.68L,故C错误;
D.由于氯化铜是强酸弱碱盐,因水解该溶液呈酸性,K2闭合,是电解溶质氯化铜,氯化铜溶液的浓度下降,酸性减弱,pH值增大,故D正确;
故选C.
点评 本题考查了原电池原理和电解池原理,能正确判断电池的类型及两极的反应是解本题的关键,C选项中铜离子、氯离子放电后氢离子、氢氧根继续放电是易错点,题目难度中等.


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案科目:高中化学 来源: 题型:选择题
| A. | 需要加热才能发生的反应,一定是吸热反应 | |
| B. | 1mol酸与碱恰好中和时所放出的热量叫中和热 | |
| C. | 化学反应中的能量变化都表现为热量的变化 | |
| D. | 化学反应中的能量变化,主要是由化学键的变化引起的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
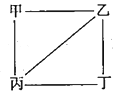 X、Y、Z、W为原子序数递增的4种短周周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如下图所示反应关系(图中“一”相连的两种物质能发生反应).下列判断正确的是( )
X、Y、Z、W为原子序数递增的4种短周周期元素,其中Y、Z为金属元素.X、Y、Z、W的最高价氧化物对应的水化物甲、乙、丙、丁之间存在如下图所示反应关系(图中“一”相连的两种物质能发生反应).下列判断正确的是( )| A. | X是元素周期表中非金属性最强的元素 | |
| B. | Z位于元素周期表第3周期IA族 | |
| C. | 4种原子中,Y原子半径最小 | |
| D. | W的阴离子可能促进水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
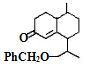
| A. | 属于芳香烃 | B. | 是高分子化合物 | ||
| C. | 可使溴水和酸性高锰酸钾溶液褪色 | D. | 苯环上的一氯取代物有5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 MnSO4在工业中有重要应用.用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:
MnSO4在工业中有重要应用.用软锰矿浆(主要成分为MnO2和水,含有Fe2O3、FeO、Al2O3和少量PbO等杂质)浸出制备MnSO4,其过程如下:| 离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Pb2+ |
| 开始沉淀时的pH | 7.6 | 2.7 | 3.8 | 8.3 | 8.0 |
| 完全沉淀时的pH | 9.7 | 3.7 | 4.7 | 9.8 | 8.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:C>D>B>A | |
| B. | C与B形成的两种化合物均属于离子化合物,且化学键类型完全相同 | |
| C. | 最简单气态氢化物的稳定性:B>A | |
| D. | A、D、E的最高价氧化物对应水化物的酸性逐渐增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图是NaCl晶体的一个晶胞结构棋型,KO2的晶体结构与NaCl的相似,KO2可以看做是Na+的位置被K+代替,Cl-的位置被O2-代替代替.则下列关于KO2晶体结构的叙述中正确的是( )
如图是NaCl晶体的一个晶胞结构棋型,KO2的晶体结构与NaCl的相似,KO2可以看做是Na+的位置被K+代替,Cl-的位置被O2-代替代替.则下列关于KO2晶体结构的叙述中正确的是( )| A. | 与K+距离相等且最近的O2-有8个 | |
| B. | 与K+距离相等且最近的O2-构成的多面体是六面体 | |
| C. | 一个KO2晶胞中的K+和O2-的粒子数都是4个 | |
| D. | 与K+距离相等且最近的K+有8个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com