
【题目】下列说法中正确的是
A.由Na2CO3 + SiO2 ![]() Na2SiO3 + CO2↑可知,酸性H2SiO3>H2CO3
Na2SiO3 + CO2↑可知,酸性H2SiO3>H2CO3
B.氢氟酸需要密封存放在橡胶塞的玻璃试剂瓶中
C.向硅酸钠溶液中加入盐酸产生白色沉淀,过量时沉淀溶解
D.瓷坩埚、氧化铝坩埚均不可作为融化NaOH固体的装置
 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. Na投入到CuSO4溶液中:2Na+Cu2+=2Na++Cu
B. 用石墨电极电解CuCl2溶液:2Cu2++2H2O![]() 2Cu↓+4H++O2↑
2Cu↓+4H++O2↑
C. 向Na2S2O3溶液中滴加等物质的量的稀硫酸:S2O32-+2H+=S↓+SO42-+H2O
D. 向Mg(OH)2沉淀中滴加过量氯化铵溶液:Mg(OH)2+2NH4+=Mg2++2NH3·H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
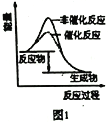


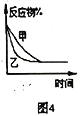
A. 图1表示分别在有、无催化剂的情况下某吸热反应过程中的能量变化
B. 图2表示常温下,等量锌粉与足量的等浓度的盐酸反应(滴加CuSO4溶液的为虚线)
C. 图3表示mg冰醋酸加水稀释过程中溶液导电能力的变化,其中醋酸的电离度c>b>a
D. 图4表压强对合成氨反应的影响,乙的压强大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图装置进行实验,甲乙两池均为1 mol·L–1的AgNO3溶液,A、B均为Ag电极。实验开始先闭合K1,断开K2。一段时间后,断开K1,闭合K2,形成浓差电池,灵敏电流计指针发生偏转(提示:Ag+ 浓度越大,氧化性越强),下列说法不正确的是
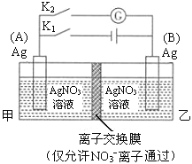
A.闭合K1,断开K2后,A电极增重
B.闭合K1,断开K2后,乙池溶液中Ag+浓度增大
C.断开K1,闭合K2后,B电极发生氧化反应
D.断开K1,闭合K2后,NO3–向A电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究新制氯水成分及性质的实验中,依据下列方法和现象,不能得出相应结论的是
方法 | 现象 | 结论 | |
A | 观察氯水颜色 | 氯水呈黄绿色 | 氯水中含Cl2 |
B | 向饱和NaHCO3溶液中加入足量氯水 | 有无色气体产生 | 氯水中含HClO |
C | 向红色纸条上滴加氯水 | 红色纸条褪色 | 氯水具有漂白性 |
D | 向FeCl2溶液中滴加氯水 | 溶液变成棕黄色 | 氯水具有氧化性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列是部分矿物资源的利用及产品流程(如图),有关说法不平确的是
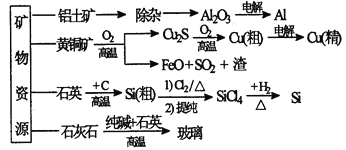
A. 粗铜电解精炼时,粗铜作阳极
B. 生产铝、铜、高纯硅及玻璃过程中都涉及氧化还原反应
C. 黄铜矿冶铜时,副产物SO2可用于生产硫酸,FeO可用作冶铁的原料
D. 粗硅制高纯硅时,提纯四氯化硅可用多次分馏的方法
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等物质的量的金属Na、Mg、Al分别与100 mL 2 mol·L-1的盐酸反应,实验测得生成气体的体积V (已折合为标准状况)与时间t的关系如图所示,则下列说法错误的是
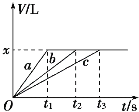
A. x=2.24 B. 曲线b为Mg与盐酸反应的图象
C. 反应时,Na、Mg、Al均过量 D. 钠的物质的量为0.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向80mL浓硫酸中加入56g铜片,加热一段时间后,至不再反应为止,计算:
(1)实验测得反应中共有13.44L标准状况下的SO2生成,被还原的硫酸的物质的量为_____mol,反应中转移的电子有_____mol。
(2)将反应后的混合物加水稀释到100mL并除去不溶物,加入足量锌粉放出标准状况下5.376L氢气,则原浓硫酸的物质的量浓度为_____,反应的Zn的质量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①KClO3 + HCl-----Cl2↑+ KCl + H2O
②Cl2+2KI═2KCl+I2
③I2+5Cl2+6H2O═2HIO3+10HCl
回答下列问题:
(1)反应③中氧化产物是__________(填化学式)
(2)配平反应①并用单线桥法表示该反应中电子转移的方向和数目___KClO3 + ___HCl=_____Cl2↑+____ KCl + ____H2O,______________。
(3)下列说法正确的是______。
A. 反应③中氧化剂和还原剂的物质的量之比为1:5
B.结合反应②③,若将Cl2通入含有淀粉的KI溶液中,可能会观察到先变蓝后褪色
C.还原性由强到弱顺序:Cl-> I-
D.氧化性由强到弱顺序:KClO3>Cl2>I2
(4)实验室用反应①可以制取Cl2,若反应消耗24.5g KClO3,则至少需用________mL 6mol/LNaOH溶液吸收产生的氯气。写出吸收氯气的离子方程式:______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com