
【题目】【2017届河南省南阳一中高三上周考五】剧毒物氰化钠(NaCN)固体遇水或酸生成剧毒易燃的HCN气体,同时HCN又能与水互溶,造成水污染。已知部分弱酸的电离平衡常数如下表:
弱酸 | HCOOH | HCN | H2CO3 |
电离平衡常数 (25°C) | Ka=l. 77×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5. 6×10-11 |
下列选项错误的是
A.向NaCN溶液中通入少量的CO2发生的离子反应为:2CN-+H2O+CO2= 2HCN+CO32-
B.室温下,处理含CN-废水时,如用NaOH溶液调节pH至9,此时c(CN-)<c(HCN)
C.中和等体积、等pH的HCOOH溶液和HCN溶液消耗NaOH的物质的量前者小于后者
D.等体积、等物质的量浓度的HCOONa和NaCN溶液中所含离子总数前者大于后者
【答案】A
【解析】
试题分析:A.酸的电离平衡常数越大,酸的酸性越强,根据电离平衡常数知,酸性HCOOH>H2CO3>HCN>HCO3-,结合强酸制取弱酸知,该反应方程式为CN-+H2O+CO2=HCN+HCO3-,A错误;B.HCN为弱酸,NaCN溶液水解溶液显显碱性;HCN的Ka=6.17×10-10,根据其水解方程式CN-+H2O![]() HCN+OH-,得水解平衡常数Kh=Kw/Ka=1014/5.0×1010=2×10-5=c(OH)·c(HCN)/c(CN)=105×c(HCN)/c(CN),所以c(CN-)<c(HCN),C正确;C.等pH的HCOOH和HCN,c(HCOOH)<c(HCN),等体积等pH的醋酸和HCN,HCN的物质的量多,中和等pH、等体积的醋酸和HCN溶液,消耗的n(NaOH)与酸的物质的量成正比,所以HCN消耗的NaOH多,C正确;D.根据电荷守恒,c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+)+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以甲酸钠中离子总数多,D正确;答案选A。
HCN+OH-,得水解平衡常数Kh=Kw/Ka=1014/5.0×1010=2×10-5=c(OH)·c(HCN)/c(CN)=105×c(HCN)/c(CN),所以c(CN-)<c(HCN),C正确;C.等pH的HCOOH和HCN,c(HCOOH)<c(HCN),等体积等pH的醋酸和HCN,HCN的物质的量多,中和等pH、等体积的醋酸和HCN溶液,消耗的n(NaOH)与酸的物质的量成正比,所以HCN消耗的NaOH多,C正确;D.根据电荷守恒,c(HCOO-)+c(OH-)=c(Na+)+c(H+),c(CN-)+c(OH-)=c(Na+)+c(H+),即离子总数是n(Na+)+n(H+)的2倍,而NaCN的水解程度大,即NaCN溶液中的c(OH-)大,c(H+)小,c(Na+)相同,所以甲酸钠中离子总数多,D正确;答案选A。


 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5。回答下列问题:
(1) 已知AX3的熔点和沸点分别为-93.6 ℃和76 ℃,AX5的熔点为167 ℃。室温时AX3与气体X2反应生成1 mol AX5,放出热量123.8 kJ。该反应的热化学方程式为_____________。
(2) 反应AX3(g)+X2(g) ===AX5(g)在容积为10 L的密闭容器中进行。起始时AX3和X2均为0.2 mol。反应在不同条件下进行,反应体系总压强随时间的变化如图所示。

① 列式计算实验a从反应开始至达到平衡时的反应速率v(AX5)=__________。
② 图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,实验b改变的实验条件及判断依据是 。
③ 用p0表示开始时总压强,p表示平衡时总压强,α表示AX3的平衡转化率,则α的表达式为__________;实验a和c的平衡转化率:αa为________,αc为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。在一定温度下,用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的盐酸和醋酸溶液,滴定曲线如图所示。下列有关判断正确的是

A. B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
B. A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L
C. C点水电离的c(OH-)大于A点水电离的c(OH-)
D. A、B、C三点溶液均有Kw=c(H+)·c(OH-)=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各组离子中,能大量共存的( )
A. Ag+、NO3﹣、Na+、Cl﹣ B. K+、HCO3﹣、Cl﹣、Al3+
C. NO3﹣、Fe2+、H+、Br﹣ D. K+、Cl﹣、SO42﹣、NH4+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(11分)下表是元素周期表短周期的一部分
① | ||||||||
② | ③ | ④ | ||||||
⑤ | ⑥ | ⑦ | ||||||
(1)①—⑦元素中金属性最强的元素位于周期表第 周期 族。
(2)可作为半导体材料的是 (写元素符号)。
(3)表中元素⑥的原子结构示意图为 。
(4)④与⑤形成的常见化合物的化学键的类型为 ,该化合物的电子式为 。
(5)表中元素①、②、③、⑤、⑦中,原子半径由大到小的顺序是 (填数字序号)
(6)表中元素③、⑥它们最高价氧化物的水化物相互反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时纯水的电离度为a1,pH=2的醋酸溶液的电离度为a2,pH=12的氢氧化钠溶液中水的电离度为a3。若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离度为a1。下列关系式中正确的是
A.a2=a3<a4<a1 B.a3 = a2<a1<a4
C.a2<a3<a1<a4 D.a1<a2<a3<a4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在原子序数1~18号元素中:(用化学式表示)
(1)与水反应最剧烈的金属是_____________。
(2)与水反应最剧烈的非金属单质是_____________。
(3)在室温下有颜色的气体单质是_______________________________。
(4)最高价氧化物对应的水化物中酸性最强的是_______________________________。
(5)除稀有气体外,原子半径最大的元素是____________,它的原子结构示意图是_______________。
(6)气态氢化物最稳定的物质是_______。
(7)写出四原子18电子且既含有极性键又含有非极性键的物质的分子式_______________,用电子式表示其形成过程_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“保护环境”是我国的基本国策。下列做法不应该提倡的是
A. 生活垃圾分类收集 B. 垃圾进行露天焚烧
C. 宣传“低碳”出行 D. 合理使用化肥农药
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016全国卷1】298 K时,在20.0 mL 0.10 mol![]() 氨水中滴入0.10 mol
氨水中滴入0.10 mol![]() 的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol
的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol![]() 氨水的电离度为1.32%,下列有关叙述正确的是
氨水的电离度为1.32%,下列有关叙述正确的是
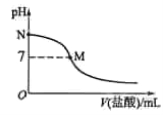
A.该滴定过程应该选择酚酞作为指示剂
B.M点对应的盐酸体积为20.0 mL
C.M点处的溶液中c(NH4+)=c(Cl-)=c(H+)=c(OH-)
D.N点处的溶液中pH<12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com