
【题目】下列各组物质中,所含分子数一定相同的是( )
A.1 g H2和8 g O2B.标况时,18 L H2O和18 L CO2
C.0.1 mol HCl和2.24 L HeD.28 g CO和6.02×1023个CO分子
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】有机化合物在人类生活和生产中必不可少,下列对有机化合物的叙述不正确的是( )
A.甲烷是天然气的主要成分,是最简单的烃,其含碳量为75%
B.乙醇的分子式为![]() ,常温下是一种无色液体,密度比水小
,常温下是一种无色液体,密度比水小
C.乙酸的结构简式是![]() ,易溶于水,酸性比
,易溶于水,酸性比![]() 的强
的强
D.乙烯是重要的化工原料,能使溴水和酸性高锰酸钾溶液褪色,其原理均是乙烯具有漂白作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】祖母绿被称为绿宝石之王,是四大名贵宝石之一,其主要成分为Be3Al2Si6O18,因含有微量的Cr、Ni、Fe元素而呈现各种颜色。回答下列问题:
(1)祖母绿宝石属于晶体,鉴别晶体最可靠的科学方法是_____________。
(2)基态Cr原子的价层电子排布式为_________;基态Si原子电子占据最高能级的电子云轮廓图为_________。
(3)六羰基铬[Cr(CO)6]用于制高纯度铬粉,它的沸点为220℃。Cr(CO)6的晶体类型是_______,1 mol Cr(CO)6中含σ键的数目为_________;
(4)BeCl2分子的空间构型是_________,写出该分子的一种等电子体的分子式_________。它的二聚体Be2Cl4结构如图所示Cl-Be![]() Be-Cl,,其中Be原子的杂化方式是_________。
Be-Cl,,其中Be原子的杂化方式是_________。
(5)BeO的立方晶胞如图所示,在该晶胞中与一个O2-距离最近且相等的O2-有________个。若该晶体的密度为d g·cm-3,设阿伏加德罗常数的值为NA,则晶胞边长a=________nm。(列出计算表达式)
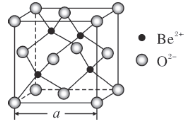
(6)多数配离子显示颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用△表示),它与中心离子的结构、电荷、配体有关。试判断分裂能△[Fe(H2O)6]3+________ △[Fe(H2O)6]2+(填“>”、“=”或“<”),理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知碳碳单键可以绕键轴自由旋转,结构简式为: 的烃,下列说法正确的是( )
的烃,下列说法正确的是( )
A.分子中至少有9个碳原子处于同一平面上
B.分子中至少有11个碳原子处于同一平面上
C.分子中至少有16个碳原子处于同一平面上
D.该烃属于苯的同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2O、NO和NO2等氮氧化物是空气污染物,含有氮氧化物的尾气需处理后才能排放。
(1)N2O的处理。N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。NH3与O2在加热和催化剂作用下生成N2O的化学方程式为________。
(2)NO和NO2的处理。已除去N2O的硝酸尾气可用NaOH溶液吸收,主要反应为
NO+NO2+2OH![]() 2
2![]() +H2O
+H2O
2NO2+2OH![]()
![]() +
+![]() +H2O
+H2O
①下列措施能提高尾气中NO和NO2去除率的有________(填字母)。
A.加快通入尾气的速率
B.采用气、液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
②吸收后的溶液经浓缩、结晶、过滤,得到NaNO2晶体,该晶体中的主要杂质是________(填化学式);吸收后排放的尾气中含量较高的氮氧化物是________(填化学式)。
(3)NO的氧化吸收。用NaClO溶液吸收硝酸尾气,可提高尾气中NO的去除率。其他条件相同,NO转化为![]() 的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
的转化率随NaClO溶液初始pH(用稀盐酸调节)的变化如图所示。
①在酸性NaClO溶液中,HClO氧化NO生成Cl和![]() ,其离子方程式为________。
,其离子方程式为________。
②NaClO溶液的初始pH越小,NO转化率越高。其原因是________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某大型化工厂产生的酸性废液中含有两种金属离子:Fe3+、Cu2+,化学小组设计了如下图所示的方案对废液进行处理,以回收金属,保护环境。
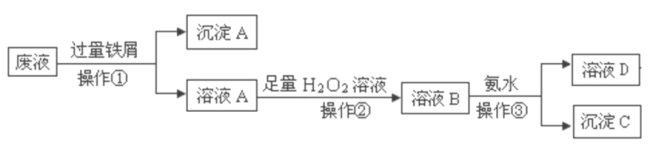
(1)操作①的名称是________________, 沉淀A中含有的金属单质有________________。
(2)溶液A中加入H2O2溶液,其作用是______________________,操作②为持续加热保温,在此过程中温度不宜过高的原因是________________________________。
(3)检验溶液B中含有的金属阳离子的实验方法为:取少量溶液B于洁净的小试管中,加入______试剂,溶液迅速转变为________色,即可检验。
(4)操作③中发生反应的离子方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,把试管放入盛有25 ℃饱和澄清石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入10 mL盐酸于试管中,试回答下列问题:
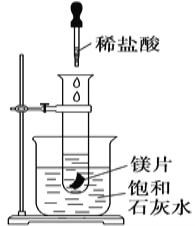
(1)实验中观察到的现象是________________________________ 。
(2)产生上述现象的原因是____________________________。
(3)写出有关反应的离子方程式:_________________________________; 反应中转移了0. 04mol电子时;标准状况下产生多少________mL的H2。
(4)由实验推知,镁片溶液和盐酸的总能量________(填“大于”、“小于”或“等于”) MgCl2和H2的总能量;此反应为________ (填放热反应或者吸热反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是
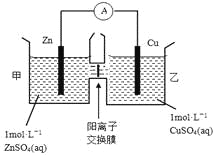
A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某镁铝合金MgxAly(其中x、y为整数)是贮氢材料,可在通入氩气的条件下,将一定化学计量比的Al、Mg单质在一定温度下熔炼制得.为测定该合金的成分,称取一定质量的样品放入600mL稀硫酸中,样品全部溶解并产生气体.待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与NaOH溶液的体积关系如图所示.完成下列问题:
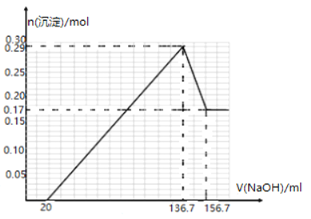
(1)熔炼制取镁铝合金(MgxAly)时通入氩气的目的是_____________。
(2)NaOH溶液的物质的量浓度为____________。
(3)该镁铝合金(MgxAly)的化学式为_____________。
(4)该合金在一定条件下吸氢的化学方程式为:MgxAly+xH2═xMgH2+yA1,得到的混合物在6.0mol·L-1HCl溶液中能完全释放出H2,1mol MgxAly完全吸氢后得到的混合物与上述盐酸完全反应,释放出H2的物质的量为__________________。
(5)将该镁铝合金置于NaOH溶液可以构成原电池,写出负极发生的反应_____________________。
(6)如图甲为甲醇燃料电池,乙池为铝制品表面“钝化”装置,两极分别为铝制品和石墨.M电极的材料是_________________。
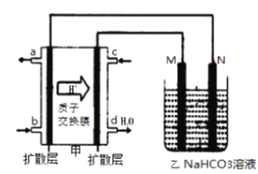
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com