¹¤ŅµŗĻ³É°±ÓėÖʱøĻõĖįŅ»°ćæÉĮ¬ŠųÉś²ś£¬Į÷³ĢČēĻĀ
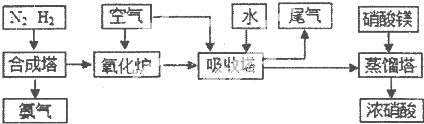
£Ø1£©¢Ł¹¤ŅµÉś²śŹ±£¬ÖĘČ”ĒāĘųµÄŅ»øö·“Ó¦ĪŖ£ŗCO+H
2O£Øg£©?CO
2+H
2£¬850”ꏱ£¬Ķł1LĆܱÕČŻĘ÷ÖŠ³äČė0.3mol COŗĶ0.2molH
2O£Øg£©£®·“Ó¦4minŗó½ØĮ¢Ę½ŗā£¬ĢåĻµÖŠc£ØH
2£©=0.12mol?L
-1£®COµÄĘ½ŗāÅضČĪŖ
0.18mol/L
0.18mol/L
×Ŗ»ÆĀŹĪŖ
40%
40%
øĆĪĀ¶ČĻĀ“Ė·“Ó¦µÄĘ½ŗā³£ŹżK=
1
1
£ØĢī¼ĘĖć½į¹ū£©£®
¢ŚŌŚ850”ꏱ£¬ŅŌ±ķÖŠµÄĪļÖŹµÄĮæĶ¶ČėŗćČŻ·“Ó¦Ę÷ÖŠ£¬ĘäÖŠĻņÄę·“Ó¦·½Ļņ½ųŠŠµÄÓŠ
A
A
£ØŃ”ĢīA”¢B”¢C”¢D”¢E£©
|
A |
B |
C |
D |
E |
| n£ØCO2£© |
3 |
l |
0 |
1 |
l |
| n£ØH2£© |
2 |
l |
0 |
1 |
2 |
| n£ØCO£© |
1 |
2 |
3 |
0.5 |
3 |
| n£ØH2O£© |
5 |
2 |
3 |
2 |
l |
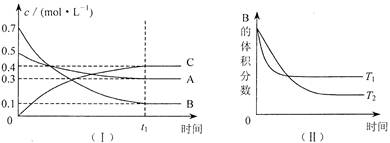
£Ø2£©ŗĻ³ÉĖžÖŠ·¢Éś·“Ó¦N
2£Øg£©+3H
2£Øg£©?2NH
3£Øg£©”÷H£¼0£®ĻĀ±ķĪŖ²»Ķ¬ĪĀ¶ČĻĀøĆ·“Ó¦µÄĘ½ŗā³£Źż£®ÓÉ“ĖæÉĶĘÖŖ£¬±ķÖŠT
1£¼
£¼
300”ę£ØĢī”°£¾”±”¢”°£¼”±»ņ”°=”±£©£®
| T/”ćC |
T1 |
300 |
T2 |
| K |
1.00”Į107 |
2.45”Į105 |
1.88”Į103 |
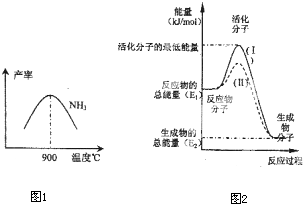
£Ø3£©N
2ŗĶH
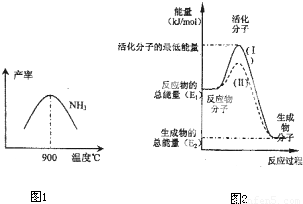
2ŌŚĢś×÷“߻ƼĮ×÷ÓĆĻĀ“Ó145”ę¾ĶæŖŹ¼·“Ó¦£¬²»Ķ¬ĪĀ¶ČĻĀNH
3²śĀŹĶ¼1ĖłŹ¾£®ĪĀ¶ČøßÓŚ900”ꏱ£¬NH
3²śĀŹĻĀ½µ£¬ŌŅņŹĒ
900”ꏱ·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬ŌŁÉżøßĪĀ¶ČĘ½ŗāĻņ×óŅʶÆ
900”ꏱ·“Ó¦“ļµ½Ę½ŗāדĢ¬£¬ŌŁÉżøßĪĀ¶ČĘ½ŗāĻņ×óŅʶÆ
£®
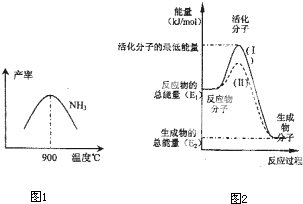
£Ø4£©ŌŚ»Æѧ·“Ó¦ÖŠÖ»ÓŠ¼«ÉŁŹżÄÜĮæ±ČĘ½¾łÄÜĮæøߵƶąµÄ·“Ó¦Īļ·Ö×Ó·¢ÉśÅöײŹ±²ÅæÉÄÜ·¢Éś»Æѧ·“Ó¦£¬ÕāŠ©·Ö×Ó±»³ĘĪŖ»ī»Æ·Ö×Ó£®Ź¹ĘÕĶØ·Ö×Ó±ä³É»ī»Æ·Ö×ÓĖłŠčĢį¹©µÄ×īµĶĻŽ¶ČµÄÄÜĮ潊»ī»ÆÄÜ£¬Ę䵄Ī»Ķس£ÓĆkJ?mol
-1±ķŹ¾£®ĒėČĻÕę¹Ū²ģĶ¼2£¬»Ų“šĪŹĢā£®
Ķ¼ÖŠĖłŹ¾·“Ó¦ŹĒ
·ÅČČ
·ÅČČ
£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©·“Ó¦£¬øĆ·“Ó¦µÄ”÷H=
-£ØE1-E2£©kJ/mol
-£ØE1-E2£©kJ/mol
£ØÓĆŗ¬E
1ӢE
2EµÄ“śŹżŹ½±ķŹ¾£©£®ŅŃÖŖČČ»Æѧ·½³ĢŹ½£ŗH
2£Øg£©+
O
2£Øg£©=H
2O£Øg£©”÷H=-241.8kJ?mol
-1£¬øĆ·“Ó¦µÄ»ī»ÆÄÜĪŖ167.2kJ?mol
-1£¬ŌņĘäÄę·“Ó¦µÄ»ī»ÆÄÜĪŖ
409kJ/mol
409kJ/mol
£®
£Ø5£©ĻõĖį³§µÄĪ²ĘųÖ±½ÓÅŷŽ«ĪŪČ¾æÕĘų£®ÄæĒ°æĘѧ¼ŅĢ½Ė÷ĄūÓĆČ¼ĮĻĘųĢåÖŠµÄ¼×ĶéµČ½«µŖµÄŃõ»ÆĪļ»¹ŌĪŖµŖĘųŗĶĖ®£¬·“Ó¦»śĄķĪŖ£ŗ
CH
4£Øg£©+4NO
2£Øg£©=4NO£Øg£©+CO
2£Øg£©+2H
2O£Øg£©”÷H=-574kJ?mol
-1CH
4£Øg£©+4NO£Øg£©=2N
2£Øg£©+CO
2£Øg£©+2H
2O£Øg£©”÷H=-1160kJ?mol
-1Ōņ¼×ĶéÖ±½Ó½«NO
2»¹ŌĪŖN
2µÄČČ»Æѧ·½³ĢŹ½ĪŖ£ŗ
CH4£Øg£©+2NO2£Øg£©=CO2£Øg£©+2H2O£Øg£©+N2£Øg£©”÷H=-867kJ?mol-1
CH4£Øg£©+2NO2£Øg£©=CO2£Øg£©+2H2O£Øg£©+N2£Øg£©”÷H=-867kJ?mol-1
£®

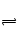 2C,ŹĒĘųĢåĢå»ż¼õŠ”µÄ·“Ó¦£¬±£³ÖĘäĖūĢõ¼ž²»±ä£¬Ōö“óŃ¹Ēæ£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ”£
2C,ŹĒĘųĢåĢå»ż¼õŠ”µÄ·“Ó¦£¬±£³ÖĘäĖūĢõ¼ž²»±ä£¬Ōö“óŃ¹Ēæ£¬Ę½ŗāĻņÕż·“Ó¦·½ĻņŅĘ¶Æ”£

 µ¼Ń§½Ģ³ĢøßÖŠŠĀæĪ±źĻµĮŠ“š°ø
µ¼Ń§½Ģ³ĢøßÖŠŠĀæĪ±źĻµĮŠ“š°ø


 CH3OH£Øg£©+H2O£Øg£©£»”÷H3
CH3OH£Øg£©+H2O£Øg£©£»”÷H3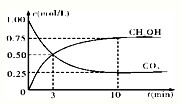
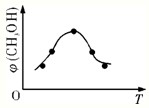
 NH3?H2O+H+
NH3?H2O+H+ NH3?H2O+H+
NH3?H2O+H+
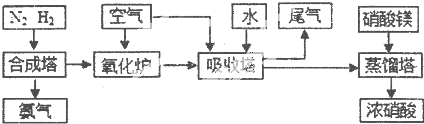

 O2£Øg£©=H2O£Øg£©”÷H=-241.8kJ?mol-1£¬øĆ·“Ó¦µÄ»ī»ÆÄÜĪŖ167.2kJ?mol-1£¬ŌņĘäÄę·“Ó¦µÄ»ī»ÆÄÜĪŖ £®
O2£Øg£©=H2O£Øg£©”÷H=-241.8kJ?mol-1£¬øĆ·“Ó¦µÄ»ī»ÆÄÜĪŖ167.2kJ?mol-1£¬ŌņĘäÄę·“Ó¦µÄ»ī»ÆÄÜĪŖ £®