
 .
.分析 有A、B、C、D、E、F六种主族元素,①A、B、C是同一周期的金属元素,原子核外有3个电子层,原子半径A>B>C,则A为Na、B为Mg、C为Al;②D、E、F是同主族非金属元素,它们与氢气化合可生成气态氢化物HD、HE、HF,均为ⅦA族元素,E的单质为液体,则E为Br;F的单质为固体,则F为I;D是除氢气外最轻的气体且性质稳定,则D为F元素,据此解答.
解答 解:有A、B、C、D、E、F六种主族元素,①A、B、C是同一周期的金属元素,原子核外有3个电子层,原子半径A>B>C,则A为Na、B为Mg、C为Al;②D、E、F是同主族非金属元素,它们与氢气化合可生成气态氢化物HD、HE、HF,均为ⅦA族元素,E的单质为液体,则E为Br;F的单质为固体,则F为I;D是除氢气外最轻的气体且性质稳定,则D为F元素.
(1)A的名称是钠,金属性Mg>Al,故简单离子的氧化性:Mg2+<Al3+,C为Al元素,原子结构示意图是  ,
,
故答案为:钠;Mg2+<Al3+;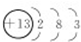 ;
;
(2)非金属性F>Br>I,故氢化物稳定性:HF>HBr>HI,非金属性越强,阴离子还原性越弱,故还原性:I->Br->F-,
故答案为:HF>HBr>HI;I->Br->F-;
(3)A元素与E元素形成化合物的化学式是NaBr,故答案为:NaBr;
(4)a.单质的熔点属于物理性质,不能比较单质氧化性强弱,故a错误;
b.溴单质能将碘从其可溶性盐溶液中置换出来,说明溴的氧化性强于碘,故b正确;
c.一定条件下溴和碘的单质都能与Na的单质反应,不能比较其氧化性强弱,可以利用与氢气反应的难易程度、剧烈程度判断,故c错误,
故选:b;
(5)在上述六种元素中,Na的金属性最强,最高价氧化物对应的水化物碱性最强的是NaOH,F元素没有最高价含氧酸,酸性最强的是HBrO4,气态氢化物最稳定的是HF,
故答案为:NaOH;HBrO4;HF;
(6)C的最高价氧化物对应的水化物为氢氧化铝,A的最高价氧化物对应的水化物为NaOH,E的最高价氧化物对应的水化物为HBrO4,氢氧化铝属于两性氢氧化物,能与强酸、强碱反应,分别与氢氧化钠、高溴酸反应离子方程式为:Al(OH)3+OH-=[Al(OH)4]-、H++OH-=H2O,
故答案为:Al(OH)3+OH-=[Al(OH)4]-、H++OH-=H2O.
点评 本题考查位置结构与性质的关系,推断元素是解题关键,注意理解掌握金属性、非金属性强弱比较的实验事实,有利于基础知识的巩固.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 煤的液化是物理变化 | |
| B. | 石油干馏可得到汽油、煤油等 | |
| C. | 淀粉、蛋白质完全水解的产物互为同分异构体 | |
| D. | 乙酸乙酯、油脂与NaOH溶液反应均有醇生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
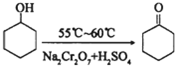
| 物质 | 相对分子质量 | 沸点(℃) | 密度(g•cm-3、20℃) | 溶解性 |
| 环己醇 | 100 | 161.1 | 0.9624 | 能溶于水和醚 |
| 环己酮 | 98 | 155.6 | 0.9478 | 微溶于水,能溶于醚 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和镁分别与冷水反应,判断金属活动性强弱 | |
| B. | 铁投入CuSO4溶液中,能置换出铜,钠投入CuSO4溶液中不能置换出铜,判断钠与铁的金属活动性强弱 | |
| C. | 酸性H2CO3<H2SO4,判断硫与碳的非金属活动性强弱 | |
| D. | Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:A>B>C>D | |
| B. | 元素金属性:B>A,元素非金属性:D>C | |
| C. | 离子半径:D(n+1)->Cn->B(n+1)+>An+ | |
| D. | 原子序数:b>a>c>d |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com