
下列关于元素周期表的说法正确的是
A.能生成碱的金属元素都在ⅠA族
B.原子序数为14的元素位于元素周期表的第3周期ⅣA族
C.稀有气体元素原子的最外层电子数均为8
D.第二周期ⅣA族元素的原子核电荷数和中子数一定为6
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
X、Y、Z、W是元素周期表中原子序数依次增大的四种短周期元素,其相关信息如下表:
| 元素 | 相关信息 |
| X | X的最高价氧化物对应的水化物化学式为H2XO3 |
| Y | Y是地壳中含量最高的元素 |
| Z | Z的基态原子最外层电子排布式为3s23p1 |
| W | W的一种核素的质量数为28,中子数为14 |
| T | 常温常压下,T单质是淡黄色固体,常在火山口附近沉积 |
| P | P的价层电子排布为[Ar]3d104s2 |
(1)W位于元素周期表第________周期第________族;W的原子半径比X的________(填“大”或“小”)。
(2)TY2中心原子的杂化方式为_______;XY2中一个分子周围有__________个紧邻分子;堆积方式与XY2晶胞类型相同的金属有_________(从“Cu、 Mg、K、Po”中选出正确的),其空间利用率为_______。
(3)Z的第一电离能比Mg的________(填“大”或“小”);写出Z单质与NaOH溶液反应的化学方程式 。
(4)写出W的最高价氧化物与NaOH溶液反应的离子方程式 ;W的最高价氧化物与XY2的熔点较高的是 ,原因是 。
(5)处理含XO、TO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质T。已知:
XO(g)+ 1/2O2(g)====XO2(g) ΔH=-283.0 kJ·mol-1
T(s)+O2(g)=====TO2(g) ΔH=-296.0 kJ·mol-1
此反应的热化学方程式是______________________________。
(6)P在周期表的 区;P和T形成的化合物PT在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方PT晶体结构如下图所示,其晶胞边长为540.0 pm,密度为_________ g·cm-3(列式并计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
[化学—选修3:物质结构与性质](15分)
有A、B、C、D、E、F、G、H原子序数递增的前四周期八种元素。请根据下列信息,回答问题:
| ①A、B、C、D、E、F为短周期主族元素,原子半径大小关系为A<D<C<B<F<E; |
| ②A与D形成的化合物常温下为液态; |
| ③B元素原子价电子(外围电子)排布为 |
| ④F元素原子的核外p电子总数比s电子总数多1; |
| ⑤第一电子能:F<E; |
| ⑥G的基态原子核外有6个外成对电子; |
| ⑦H能形成红色(或砖红色)的 |
(1)G元素基态原子的价电子排布图为 。
(2)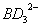 中B原子采取的杂化轨道类型为 。
中B原子采取的杂化轨道类型为 。
(3)根据等电子体原理,推测 分子的空间构型为 。
分子的空间构型为 。
(4)下列有关E、F的叙述正确的是( )
a.离子半径E>F b.电负性E<F
c.单质的熔点E>F d. E、F的单质均能与氧化物发生置换
e. E的氧化物具有两性 f. E、F均能与氯元素构成离子晶体
(5)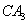 极易溶于
极易溶于 ,原因是 。
,原因是 。
(6)E单质的晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,晶胞如下图丙所示。则E单质的晶体堆积模型为 。
若已知E原子半径为r pm, 表示阿伏伽德罗常数,晶胞的变长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和
表示阿伏伽德罗常数,晶胞的变长为a。晶胞的高为h,则晶胞的密度可表示为 g/cm3。(用只含r和 代数式表示)
代数式表示)

查看答案和解析>>
科目:高中化学 来源: 题型:
对于反应A (g)+ 3B(g) = 2C(g) + 2D(g),下列数据表示反应进行得最快的是( )
A.v(A)=0.7mol/(L·s) B.v (B) =1.8mol/(L · s)
C.v (C)=1mol/(L·s) D.v (D) =1.6mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1~18号元素的离子aW3+、bX+、cY2—、dZ—都具有相同的电子层结构,下列关系正确的是( )
A.质子数:c>d B.离子的还原性:Y2—>Z —
C.氢化物的稳定性:H2Y>HZ D.原子半径:X<W
查看答案和解析>>
科目:高中化学 来源: 题型:
一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3+ + Cu ==2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e- ==Cu2+,还原反应式:2Fe3+ + 2e- ="=" 2Fe2+。并由此实现了化学能与电能的相互转化。据此,回答下列问题:
(1)将反应Zn + 2H+ = Zn2+ + H2↑拆写为两个“半反应式”:其中,氧化反应为: 。
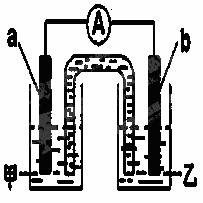
(2)由题(1)反应,设计成原电池如图所示:
若电极a为Zn ,电极b可选择材料: (只填一种);电解质溶液甲是 ;电极b处的电极反应式: 。
(3)由反应2H2 + O2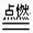 2H2O ,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:负极 ,正极 。
2H2O ,设计出以稀硫酸为电解质溶液的燃料电池,其电极反应式为:负极 ,正极 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物分子中,当某个碳原子连接着四个不同的原子或原子团时,这种碳原子称为“手性碳原子”。例如,下列有机物分子中带“*”碳原子就是手性碳原子。
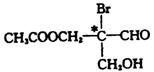 该有机物分别发生下列反应,生成的有机物分子中仍含有手性碳原子的是
该有机物分别发生下列反应,生成的有机物分子中仍含有手性碳原子的是
A.与乙酸发生酯化反应 B.与NaOH水溶液反应
C.与银氨溶液作用发生银镜反应
D.催化剂作用下与H2反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com