
【题目】现有常温条件下甲、乙、丙三种溶液,甲为0.1 mol·L-1的NaOH溶液,乙为0.1 mol·L-1的HCl溶液,丙为0.1 mol·L-1的CH3COOH溶液。试回答下列问题:
(1)甲溶液的pH=________。
(2)乙溶液中由水电离出的H+浓度为________mol·L-1。
(3)常温下,用水稀释0.1 mol·L-1的CH3COOH溶液时,下列各量随水量的增加而增大的是________(填序号)。
①n(H+) ②c(H+) ③![]() ④c(OH-)
④c(OH-)
(4)某同学用甲溶液做标准溶液分别滴定20.00 mL乙溶液和20.00 mL丙溶液,得到如图所示的两条滴定曲线,请回答有关问题:

①甲溶液滴定丙溶液的曲线是_______(填“图1”或“图2”)曲线。
②用甲溶液滴定乙溶液实验中,指示剂应选用________,滴定达到终点的现象为:____________,滴定前未用标准液润洗滴定管,则会造成滴定结果______ (填偏高、偏低或无影响)。
【答案】13 1×10-13 ①④ ① 图2 酚酞试液 溶液由无色变为淡红色,且半分钟内不褪色 偏高
【解析】
(1)0.1mol·L-1的NaOH溶液中c(OH-)=0.1mol/L,根据Kw=c(H+)·c(OH-)计算溶液中c(H+),再根据pH=-lg c(H+)计算溶液的pH值;
(2)HCl的电离抑制了水的电离,通过计算盐酸中OH-的浓度计算水电离出的H+的浓度;
(3)用水稀释①0.01mol·L-1的CH3COOH溶液,醋酸的电离程度增大,溶液中氢离子的物质的量增大,由于体积增大程度较大,所以氢离子浓度减小,据此分析判断;
(4)乙酸为弱电解质,滴定终点时,溶液呈碱性;利用NaOH滴定盐酸,滴定终点误差需根据消耗标准溶液的体积进行判断。
(1)0.1mol·L-1的NaOH溶液中c(OH-)=0.1mol/L,故溶液中c(H+)=![]() =10-13mol/L,故该溶液的pH=-lg10-13=13;
=10-13mol/L,故该溶液的pH=-lg10-13=13;
(2)HCl为强电解质,在水溶液中完全电离,电离出H+和Cl-,0.1mol/L的盐酸中c(H+)=0.1mol/L,HCl的电离抑制了水的电离,水中c(OH-)=10-13mol/L,溶液中的OH-是由水电离出来的,故溶液中水电离出的c(H+)=10-13mol/L;
(3)①用水稀释0.01mol·L-1的CH3COOH溶液,醋酸的电离程度增大,溶液中氢离子的物质的量增大,故①正确;②用水稀释0.01mol·L-1的CH3COOH溶液,醋酸的电离程度增大,溶液中氢离子的物质的量增大,由于体积增大程度较大,所以氢离子浓度减小,故②错误;③加水稀释0.01mol·L-1的CH3COOH溶液,醋酸的电离平衡常数Ka不变,c(H+)减小,所以![]() 增大,则
增大,则![]() 减小,故③错误;④用水稀释0.01mol·L-1的CH3COOH溶液,c(H+)减小,Kw不变,所以c(OH-)增大,故④正确;故答案为①④;
减小,故③错误;④用水稀释0.01mol·L-1的CH3COOH溶液,c(H+)减小,Kw不变,所以c(OH-)增大,故④正确;故答案为①④;
(4)①醋酸为弱电解质,滴定过程中pH变化较盐酸缓慢,滴定终点时溶液呈碱性,则滴定醋酸溶液的曲线是图2,故答案为图2;
②滴定过程中指示剂的选择应与滴定终点的酸碱性有关,用甲溶液滴定乙溶液实验中,滴定终点的溶液呈弱碱性,故选择酚酞试液较为合适;当达到滴定终点时,溶液的颜色由无色变为淡红色,且半分钟内不褪色;若滴定前未用标准液润洗滴定管,只用蒸馏水润洗,则滴定管中溶液浓度会被稀释,加入的液体的用量较原来偏大,导致最后的计算结果偏高。


科目:高中化学 来源: 题型:
【题目】重铬酸钾溶液中存在如下平衡:(1)Cr2O72-+H2O![]() 2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,发生反应:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正确的是
2H++2CrO42-,向2mL0.1mol·L-1酸化的K2Cr2O7溶液中滴入适量(NH4)2Fe(SO4)2溶液,发生反应:Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。下列分析正确的是
A. 向K2Cr2O7溶液加入几滴浓NaOH溶液,溶液由黄色变成橙黄
B. 氧化性:Cr2O72->Fe3+
C. CrO42-和Fe2+在酸性溶液中能大量共存
D. 向K2Cr2O7溶液中加水稀释,反应(1)平衡向左移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同一周期相邻的A、B、C三种元素,都是短周期元素,A的最高价氧化物的化学式是A2O,11.6 g B的氢氧化物恰好能与200 mL 2 mol/L盐酸完全反应,B原子核中质子数与中子数相等。回答以下问题:
(1)B的相对原子质量是多少?原子序数是多少?_____________
(2)A和C各是什么元素?_____________
(3)A、B、C的单质各1 mol分别与足量的稀硫酸反应,产生H2最多的是哪一种单质?该单质产生H2的体积在标准状况下是多少?_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关元素及其化合物叙述中不正确的是( )
A.氧化镁和氧化铝熔点均很高,常用作耐高温材料
B.在酒精灯加热条件下,![]() 和
和![]() 固体都能分解
固体都能分解
C.二氧化氯具有氧化性,可用于自来水杀菌消毒
D.电闪雷鸣的雨天,![]() 与
与![]() 会发生反应并最终转化为硝酸盐被植物吸收
会发生反应并最终转化为硝酸盐被植物吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有V、W、X、Y、Z 五种元素,它们的核电荷数依次增大,且都小于20。其中只有X、Z 是金属元素;V和Z元素原子的最外层都只有一个电子;W和Y元素原子的最外层电子数相同,且W元素原子的L层电子数是K层电子数的3倍;X元素原子的最 外层电子数是Y元素原子最外层电子数的一半。
回答下列问题:
(1)X元素的离子结构示意图为_____________。
(2)Z的最高价氧化物对应水化物的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某结晶水合物含有两种阳离子和一种阴离子。称取两份质量均为45.3g的该结晶水合物,分别制成溶液。向其中一份逐滴加入NaOH溶液,开始发现溶液中出现白色沉淀并逐渐增多;一段时间后有气体逸出,该气体有刺激性气味,能使湿润的红色石蕊试纸变蓝,加热后共计可收集到2.24L该气体(标准状况);最后白色沉淀逐渐减少并最终消失。另一份逐滴加入Ba(OH)2溶液,开始现象类似,但最终仍有白色沉淀;过滤,用稀硝酸处理沉淀物,经洗涤和干燥,得到白色固体46.6 g。
请回答以下问题:
⑴ 该结晶水合物中含有的两种阳离子是________和________,阴离子是_________。
⑵ 试通过计算确定该结晶水合物的化学式。________
⑶ 假设过程中向该溶液中加入的NaOH溶液的物质的量浓度为5mol·L-1,请在下图中画出生成沉淀的物质的量与加入NaOH溶液体积的关系________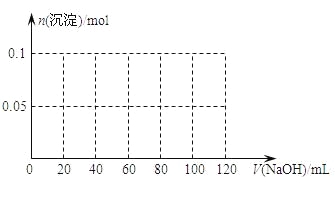
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂醛F (![]() )在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的:
)在自然界存在于桂油中,是一种常用的植物调味油,工业上主要是按如图路线合成的:
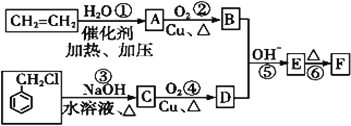
已知:两个醛分子在NaOH溶液作用下可以发生反应,生成一种羟基醛:
![]() +
+![]()
![]()
![]()
请回答:
(1)D的名称为___。
(2)反应①~⑥中属于加成反应的是___(填序号)。
(3)写出反应③的化学方程式:____,其反应类型为____。
(4)在实验室里鉴定![]() 分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是___(请按实验步骤操作的先后次序填写序号)。
分子中的氯元素时,是将其中的氯元素转化为AgCl白色沉淀来进行的,其正确的操作步骤是___(请按实验步骤操作的先后次序填写序号)。
A.滴加AgNO3溶液 B.加NaOH溶液 C.加热 D.用稀硝酸酸化
(5)E的同分异构体有多种,其中之一甲属于酯类。甲可由H(已知H的相对分子量为32)和芳香酸G制得,则甲的结构共有___种。
(6)根据已有知识并结合相关信息,写出以乙烯为原料制备CH3CH=CHCHO的合成路线流程图(无机试剂任选)。______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
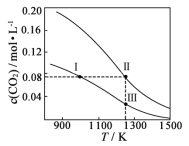
A.反应CO2(g)+C(s) ![]() 2CO(g)的ΔS>0、ΔH<0
2CO(g)的ΔS>0、ΔH<0
B.体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C.体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D.逆反应速率:v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图有机物分子中带“![]() ”碳原子就是手性碳原子。该有机物分别发生下列反应,生成的有机物分子中仍含有手性碳原子的是
”碳原子就是手性碳原子。该有机物分别发生下列反应,生成的有机物分子中仍含有手性碳原子的是

A.与乙酸发生酯化反应B.与NaOH水溶液反应
C.与银氨溶液作用只发生银镜反应D.催化剂作用下与![]() 反应
反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com