
 根据要求回答下列问题:
根据要求回答下列问题: +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$ +2H2O.
+2H2O. 1molNaOH溶液反应最多消耗4molNaOH,1mol该物质因发生加成反应可消耗1molBr2.
1molNaOH溶液反应最多消耗4molNaOH,1mol该物质因发生加成反应可消耗1molBr2. 该分子中一定与苯环处于同一平面的碳原子有4个(不包括苯环上的碳原子),分子中含有2种双键.
该分子中一定与苯环处于同一平面的碳原子有4个(不包括苯环上的碳原子),分子中含有2种双键. 分析 (1)CO2通入苯酚钠溶液反应生成苯酚和碳酸氢钠;1,2-丙二醇催化氧化生成 和水;
和水;
(2)根据成键结构知,灰色球表示表示C原子、黑色球表示O原子、白色球表示H原子,则乙醇醛的结构简式为HOCH2CHO,含有醇羟基和醛基,具有醇和醛的性质,能发生氧化反应、加成反应、还原反应、取代反应,据此分析解答;
(3)分子中的酚羟基、酯基和羧基能与NaOH反应,碳碳双键与溴单质发生加成反应;
(4)结合苯环的平面形结构特点解答该题.
解答 解:(1)反应生成苯酚和碳酸氢钠,反应的化学方程式为C6H5ONa+CO2+H2O→C6H5OH+NaHCO3,离子反应为C6H5O-+CO2+H2O→C6H5OH+HCO3-,1,2-丙二醇催化氧化生成 和水,其反应方程式为:
和水,其反应方程式为: +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$ +2H2O;
+2H2O;
故答案为:C6H5O-+CO2+H2O→C6H5OH+HCO3-; +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$ +2H2O;
+2H2O;
(2)灰色球表示表示C原子、黑色球表示O原子、白色球表示H原子,则乙醇醛的结构简式为HOCH2CHO,
A.含有醇羟基和醛基两种含氧官能团,故A正确;
B.含有醛基,所以能发生银镜反应,故B正确;
C.该分子中只含一个醇羟基,葡萄糖是含有多个醇羟基,所以二者不是同系物,故C错误;
D.与乙酸分子式相同、结构不同,所以与乙酸互为同分异构体,故D正确;
故选C.
(3)分子中的酚羟基、酯基和羧基能与NaOH反应,该分子中含有一个酚羟基,一个酯基,酯基水解后又生成一个酚羟基,一个羧基,所以1mol该物质最多消耗4molNaOH;碳碳双键与溴单质发生加成反应,分子中含有一个C=C,所以1mol该物质因发生加成反应可消耗1molBr2,
故答案为:4;1;
(4)与苯环直接相连的原子与苯环共平面,C≡C为直线形,则分子中一定与苯环处于同一平面的碳原子数有4个,分子中含有C=C、C=O两种双键,
故答案为:4;2.
点评 本题考查有机物结构和性质,侧重于学生的分析能力的考查,明确官能团及性质的关系即可解答,题目难度不大.


 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案科目:高中化学 来源: 题型:解答题
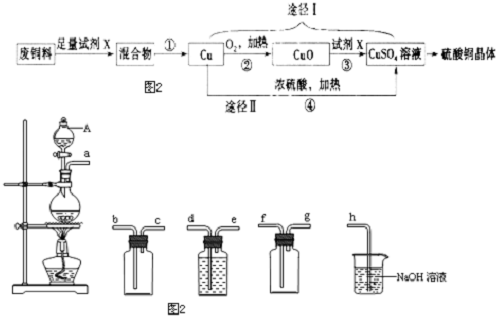
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦ | B. | ②③⑦ | C. | ①⑥ | D. | ②④⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
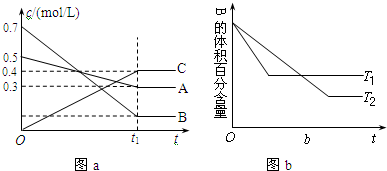
| A. | 其他条件不变,升高温度,正、逆反应速率均增大,且A的转化率增大 | |
| B. | T℃时,若在该容器中由0.4mol/LA、0.4mol/LB和0.2mol/LC反应,达到平衡后,C的浓度仍为0.4mol/L | |
| C. | 在(t1+10)min时,保持其他条件不变,增大压强,平衡向逆反应方向移动 | |
| D. | (t1+10)min时,保持压强不变,通入稀有气体,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子交换膜在工业生产中广泛应用,如氯碱工业使用了阴离子交换膜 | |
| B. | 向煤中加入适量CaSO4,可大大减少燃烧产物中SO2的量 | |
| C. | “低碳生活”倡导生活中尽量减少耗能,从而减少CO2排放 | |
| D. | 铝表面有一层致密的氧化物薄膜,故铝制容器可用来腌制咸菜等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA | |
| B. | 26g乙炔所含共用电子对数目为3NA | |
| C. | 标准状况下,11.2 L CCl4所含分子数为0.5NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com