
| 序号 | 实验 目的 | 实验内容 | 实验现象 | 实验结论 | 离子方程式 |
| 实验1 | ① | 在FeCl2溶液中滴入适量 氯水 | 溶液由浅绿色 变为黄色 | ② | ③ |
| 实验2 | ④ | 在FeCl2溶液中加入锌片 | / | ⑤ | Zn+Fe2+═Zn2++Fe |
| 实验3 | ⑥ | 在FeCl3溶液中加入足量 铁粉 | ⑦ | FeCl3(Fe3+)具有氧化性 | ⑧ |
| 实验4 | ⑨ | 在FeCl3溶液中滴入适量KI溶液和 淀粉溶液 | 淀粉溶液变蓝 | ⑩ | 2Fe3++2I-═2Fe2++I2 |
分析 (1)由实验过程及结论可知,实验1的实验目的是验证Fe2+具有还原性,在FeCl2溶液中滴入适量氯水,根据实验现象可知,氯化亚铁能被氯气氧化,生成铁离子和氯离子;
实验2的实验目的是验证Fe2+具有氧化性,能被锌置换出来,生成铁单质和锌离子;实验3的实验目的是FeCl3(Fe3+)具有氧化性,铁离子与铁单质反应生成亚铁离子;实验4的实验目的是证明Fe3+具有氧化性,能将碘离子氧化成碘单质,用淀粉检验,据此答题;
(2)FeCl2是盐,也可以与氢氧化钠等反应生成氢氧化亚铁沉淀;
(3)亚铁盐在溶液中加入少量的铁粉可以防止亚铁离子被氧化;
(4)检验某溶液是Fe2+溶液的方法可以用K3[Fe(CN)6]溶液,看能否产生蓝色沉淀,也可以用KSCN溶液及氯水,KSCN溶液与亚铁离子没有明显现象,而遇铁离子能显血红色,据此答题;
(5)某同学向FeCl2中加入NaClO溶液能氧化亚铁离子生成铁离子,铁离子可以转化成氢氧化铁.
解答 解:(1)由实验过程及结论可知,实验1的实验目的是验证Fe2+具有还原性,在FeCl2溶液中滴入适量氯水,根据实验现象可知,氯化亚铁能被氯气氧化,生成铁离子和氯离子,反应的离子方程式为2Fe2++Cl2══2Fe3++2Cl-,实验2的实验目的是验证Fe2+具有氧化性,能被锌置换出来,生成铁单质和锌离子,所以实验结论是证明Fe2+具有氧化性,实验3的实验目的是FeCl3(Fe3+)具有氧化性,铁离子与铁单质反应生成亚铁离子,实验现象为溶液由黄色变为浅绿色,实验4的实验目的是证明Fe3+具有氧化性,能将碘离子氧化成碘单质,用淀粉检验,实验结论为证明Fe3+具有氧化性,综合以上实验,得到的结论是Fe3+有氧化性;Fe2+既有氧化性,又有还原性,
故答案为:①验证Fe2+具有还原性; ③2Fe2++Cl2══2Fe3++2Cl-;⑤证明Fe2+具有氧化性;⑧2Fe3++Fe══3Fe2+;⑩证明Fe3+具有氧化性;⑪Fe3+有氧化性;Fe2+既有氧化性,又有还原性;
(2)FeCl2是盐,也可以与氢氧化钠等反应生成氢氧化亚铁沉淀,反应的离子方程式为Fe2++2OH-=2Fe(OH)2↓,
故答案为:Fe2++2OH-=2Fe(OH)2↓;
(3)亚铁盐在溶液中加入少量的铁粉可以防止亚铁离子被氧化,
故答案为:加入少量铁粉;
(4)检验某溶液是Fe2+溶液的方法可以用K3[Fe(CN)6]溶液,看能否产生蓝色沉淀,也可以用KSCN溶液及氯水,KSCN溶液与亚铁离子没有明显现象,而遇铁离子能显血红色,所以检验的方法为加入KSCN溶液,无现象,再加入氯水(双氧水等合理氧化剂),溶液变血红色,或者加入K3[Fe(CN)6]产生蓝色沉淀,
故答案为:加入KSCN溶液,无现象,再加入氯水(双氧水等合理氧化剂),溶液变血红色,或者加入K3[Fe(CN)6]产生蓝色沉淀;
(5)某同学向FeCl2中加入NaClO溶液能氧化亚铁离子生成铁离子,铁离子可以转化成氢氧化铁,氢氧化铁沉淀为红褐色,
故答案为:NaClO将Fe2+氧化为Fe3+,Fe3+转化为Fe(OH)3沉淀.
点评 本题考查性质实验方案的设计,为高频考点,把握发生的氧化还原反应原理及反应中元素的化合价变化为解答的关键,侧重分析能力、实验能力及归纳能力的考查,题目难度中等.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:解答题
| 实验步骤和方法 | 实验现象 |
| ①把7瓶液体分别依次标号A、B、C、D、E、F、G后,闻气味 | 只有F、G两种液体没有气味 |
| ②各取少量于试管中加水稀释 | 只有C、E、D三种液体不溶解而浮在水面上 |
| ③分别取少量7种液体于试管中加新 制Cu(OH)2悬浊液并加热 | 只有B使沉淀溶解,F中产生砖红色沉淀 |
| ④各取少量C、E、D于试管中,加稀NaOH 溶液并加热 | 加热前D的试管中闻 到特殊香味,加热后只有C仍有分层现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用如图装置研究电化学原理,下列分析中错误的是( )
用如图装置研究电化学原理,下列分析中错误的是( )| 选项 | 连接 | 电极材料 | 分析 | |
| a | b | |||
| A | K1 K2 | 石墨 | 铁 | 模拟铁的吸氧腐蚀 |
| B | K1 K2 | 锌 | 铁 | 模拟钢铁防护中牺牲阳极的阴极保护法 |
| C | K1 K3 | 石墨 | 铁 | 模拟电解饱和食盐水 |
| D | K1 K3 | 铁 | 石墨 | 模拟钢铁防护中外加电流的阴极保护法 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
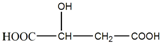
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 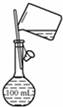 配制150mL 0.1 mol/L盐酸 | B. | 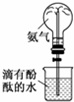 验证氨水呈碱性 | ||
| C. | 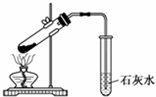 探究NaHCO3的热稳定性 | D. | 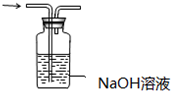 除去二氧化碳中的氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应生成1mol N2时转移4mole- | |
| B. | 反应物能量之和大于生成物能量之和 | |
| C. | N2O(g)+NO(g)═N2(g)+NO2(g)△H=-139 kJ/mol | |
| D. | 断键吸收能量之和小于成键释放能量之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
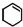 )为原料合成,路线如下(部分反应条件略):
)为原料合成,路线如下(部分反应条件略):
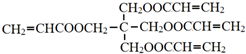


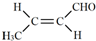 .
.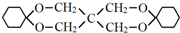 .
.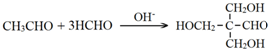 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
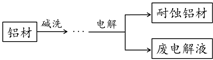 铝自然形成的氧化膜易脱落.以硫酸为电解液,分别以石墨和铝材做阴、阳极材料,经过电解处理形成的氧化铝膜,抗蚀能力强.其制备的简要流程如图.下列用来解释流程中反应的方程式不正确的是( )
铝自然形成的氧化膜易脱落.以硫酸为电解液,分别以石墨和铝材做阴、阳极材料,经过电解处理形成的氧化铝膜,抗蚀能力强.其制备的简要流程如图.下列用来解释流程中反应的方程式不正确的是( )| A. | 碱洗目的是除去铝材表面的自然氧化膜:2OH-+Al2O3═2AlO2-+H2O | |
| B. | 碱洗时铝材表面会出现气泡:2Al+2OH-+2H2O═2AlO2-+3H2↑ | |
| C. | 获得耐蚀铝材的电极反应为:4Al-12e-+3O2═2Al2O3 | |
| D. | 用稀氨水洗去耐蚀铝材表面的酸:NH3•H2O+H+═NH4++H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑤②③ | B. | ④②③ | C. | ⑤②④ | D. | ①②③ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com