
【题目】工业上可利用“甲烷蒸气转化法生产氢气”,反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量(%)的影响如下图1:
CO(g)+3H2(g)。已知温度、压强和水碳比[n(H2O)/ n(CH4)]对甲烷平衡含量(%)的影响如下图1:

图1(水碳比为3) 图2(800℃)
(1)CH4(g)+H2O(g)![]() CO(g)+3H2(g) 的△H_______0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将_____________移动(填“向正应方向”、“向逆反应方向”或“不”)。
CO(g)+3H2(g) 的△H_______0(填“>”或“<”);若在恒温、恒压时,向该平衡体系中通入氦气平衡将_____________移动(填“向正应方向”、“向逆反应方向”或“不”)。
(2)温度对该反应的反应速率和平衡移动的影响是_______________________。
(3)其他条件不变,请在图2中画出压强为2 MPa时,甲烷平衡含量(%)与水碳比之间关系曲线___________。(只要求画出大致的变化曲线)
(4)已知:在700℃,1MPa时,1mol CH4与1mol H2O在2L的密闭容器中反应,6分钟达到平衡,此时CH4的转化率为80%,求这6分钟H2的平均反应速率和该温度下反应的平衡常数是多少________?(写出计算过程,结果保留小数点后一位数字。)
【答案】 ﹥ 向正反应方向 其他条件不变,升高温度,反应速率加快,平衡向正反应方向移动(或描述降温的变化) 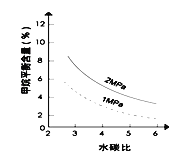 CH4(g)+H2O(g)
CH4(g)+H2O(g) ![]() CO(g)+3H2(g)
CO(g)+3H2(g)
起始浓度(mol/L): 0.5 0.5 0 0
变化浓度(mol/L):0.4 0.4 0.4 1.2
平衡浓度(mol/L):0.1 0.1 0.4 1.2
![]()
![]()
【解析】试题分析:(1)从图1看出温度升高,甲烷的含量降低,正反应为吸热反应,反应热△H>0;若在恒温恒压时,向该平衡体系中通入氦气,使容器体积变大,平衡向气体体积增大的方向移动,即向正反应方向移动;
(2)由图象可知,其他条件不变,升高温度,反应速率加快,甲烷的百分含量减小,平衡向正反应方向移动;
(3)其他条件不变,压强为2MPa时,CH4平衡含量随水碳比的增大而减小,其关系曲线为

(4)根据化学平衡三段式计算 CH4(g)+H2O(g)CO(g)+3H2(g)
起始浓度(mol/L):0.5 0.5 0 0
变化浓度(mol/L):0.4 0.4 0.4 1.2
平衡浓度(mol/L):0.1 0.1 0.4 1.2
v(H2)=△c(H2)/ △t=1.2mol/L÷6min=0.2molL-1min-1;
平衡常数K=![]() =69.1。
=69.1。


科目:高中化学 来源: 题型:
【题目】下列有机物的系统命名法正确的一组是( )
A.新戊烷 C(CH3)4
B.3﹣乙基﹣1﹣丁烯 ![]()
C.2﹣甲基﹣2,4﹣己二烯 ![]()
D.2,2,3﹣三甲基戊烷 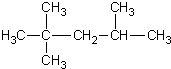
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,将0.1 mol N2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃ 的恒温槽中,烧瓶内气体逐渐变为红棕色:N2O4(g)![]() 2NO2 (g)。下列结论不能说明上述反在该条件下已经达到平衡状态的是()
2NO2 (g)。下列结论不能说明上述反在该条件下已经达到平衡状态的是()
①N2O4的消耗速率与NO2的生成速率之比为1:2 ②NO2生成速率与NO2消耗速率相等
③烧瓶内气体的压强不再变化 ④烧瓶内气体的质量不再变化
⑤NO2的物质的量浓度不再改变 ⑥烧瓶内气体的颜色不再变化
⑦烧瓶内气体的平均相对分子质量不再变化 ⑧烧瓶内气体的密度不再变化。
A. ①③⑦ B. ①④⑧ C. ①②⑤ D. ④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
(1)配制0.50mol/L NaOH溶液
a.若实验中大约要使用245mL NaOH溶液,至少需要称量NaOH固体 g.
b.从图中选择称量NaOH固体所需要的仪器是(填字母): .
名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
(2)测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示.
a.写出该反应的热化学方程式(中和热为57.3kJ/mol): .
b.取50mL NaOH溶液和30mL硫酸溶液进行实验,实验数据如下表.
①请填写下表中的空白:
温度 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值(t2﹣t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50mol/L NaOH溶液和0.50mol/L硫酸溶液的密度都是1g/cm3 , 中和后生成溶液的比热容c=4.18J/(g℃).则中和热△H=(取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母) .
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某新型“防盗玻璃”为多层结构,每层中间嵌有极细的金属线。当玻璃被击碎时,与金属线相连的警报系统就会立即报警。“防盗玻璃”能报警是利用了金属的
A. 延展性 B. 导电性 C. 弹性 D. 导热性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组用如图所示装置在实验室制取HCl气体.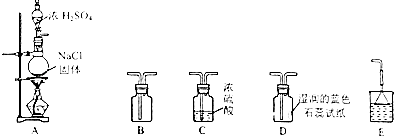
回答下列问题:
(1)装置A中微热时发生反应的化学方程式为 .
(2)若要使B中收集满干燥的HCl气体(并证实B中已收集满),则上述装置的连接顺序为:接接接接(用字母表示).
(3)实验发生以后装置D中观察到的现象是 .
(4)尾气吸收装置中加倒扣漏斗的目的是 .
(5)若将产生的HCl气体通入100g水中,得到溶质质量分数为26.74%的盐酸,则通入的HCl气体的体积在标准状况下为 L.
(6)气体发生在装置的选择要考虑反应物状态和反应条件等因素.实验室制取氧气(氯酸钾和二氧化锰)和二氧化碳的发生装置都不用装置A,其原因分别是、 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.2mol某烷烃完全燃烧后,生成的气体缓缓通过0.5L 2mol/L的NaOH溶液中,生成正盐和酸式盐的物质的量之比为1:3,则该烷烃是( )
A.甲烷
B.乙烷
C.丙烷
D.丁烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)CH3OH(g). 
(1)图1是表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况.从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=
(2)图2表示该反应进行过程中能量的变化.曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化.该反应是(选填“吸热”或“放热”)反应,写出反应的热化学方程式 .
(3)该反应平衡常数K为 , 温度升高,平衡常数K(填“增大”、“不变”或“减小”).
(4)恒容条件下,下列措施中能使 ![]() 增大的有 .
增大的有 .
a.升高温度 b.充入He气
c.再充入2molH2 d.使用催化剂.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com