
【题目】A、B、C、D是短周期元素形成的四种气体单质。E、F均为气体,且F为红棕色。有关的转化关系如下图所示(反应条件均已略去)。 请回答下列问题:

(1)D的化学式为_______________ 。
(2)反应③的离子方程式为________________________ 。
(3)Y和E在一定条件下可反应生成B和Z,这是一个具有实际意义的反应,可消除E对环境的污染,该反应的化学方程式为________________________________ 。
【答案】H2 3NO2+H2O=2H++2NO3-+NO 4NH3+6NO=5N2+6H2O
【解析】
E、F均为气体,且F为红棕色,则F是NO2,E是NO,C是O2。NO2与Z又能生成NO,则Z为H2O,G为HNO3,D为H2。Y与O2能生成NO和水,则Y是NH3,B是N2,A与NH3能产生白烟,则A是Cl2,据此答题。
(1)D的化学式为H2,故答案为:H2。
(2)反应③的离子方程式为:3NO2+H2O=2H++2NO3-+NO,故答案为:3NO2+H2O=2H++2NO3-+NO。
(3)Y是NH3,E是NO,由题意可知NH3与NO反应生成N2和H2O,反应方程式为:4NH3+6NO=5N2+6H2O,故答案为:4NH3+6NO=5N2+6H2O。


科目:高中化学 来源: 题型:
【题目】糖类、油脂、蛋白质是人类重要的营养物质。下列有关这三类物质的说法正确的是
A.均是天然高分子化合物B.均只由C、H、O三种元素组成
C.蛋白质是热值最高的营养物质D.淀粉、油脂、蛋白质在一定条件下均能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以芳香烃A(C7H8)为主要原料合成重要的医药中间体J的流程图如下:
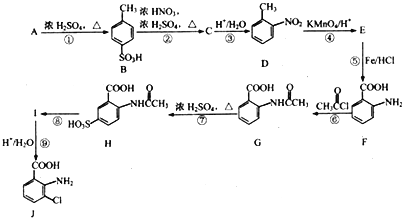
己知:①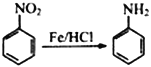 (-NH2易于被强氧化剂氧化)
(-NH2易于被强氧化剂氧化)
②![]()
③![]()
回答下列问题:
(1)A的结构简式为__________,其分子中不同化学环境的氢原子的个数比为__________。
(2)B→C 的化学方程式为_____________________,反应④的反应类型为__________。
(3)反应⑧所需试剂和条件为___________;E中含氧官能团的名称为_____________。
(4)反应⑥和⑦的顺序是否可以交换过来?__________(选填“是”或“否”)。分析⑥→⑨步的反应,其中反应⑥的主要目的是_____________________。
(5)K是J的同分异构体,其苯环上的取代基与J的相同但位置不同,则K可能的结构有__________种。
(6)请参照题中所示合成路线,以苯和![]() 为原料(无机试剂任选),设计制备
为原料(无机试剂任选),设计制备![]() 的合成路线__________。合成路线示例如下:CH3CH2OH
的合成路线__________。合成路线示例如下:CH3CH2OH![]() CH2=CH2
CH2=CH2![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一物质中(括号内),溶液能与原来溶液完全一样的是
A. CuCl2 [CuSO4] B. NaOH [NaOH] C. NaCl [HCl] D. CuSO4 [Cu(OH)2]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在3种不同条件下,分别向容积为2L的恒容密闭容器中充入2molA和1molB,发生反应:2A(g)+B(g)![]() 2D(g)△H=QkJ/mol。相关条件和数据见下表:
2D(g)△H=QkJ/mol。相关条件和数据见下表:
实验编号 | 实验I | 实验II | 实验III |
反应温度/℃ | 700 | 700 | 750 |
达平衡时间/min | 40 | 50 | 30 |
n(D)平衡/mol | 1.5 | 1.5 | 1 |
化学平衡常数 | K1 | K2 | K3 |
下列说法正确的是
A. 升高温度能加快反应速率的原理是降低了反应的活化能,使活化分子百分数提高
B. 实验III达平衡后,保持其他条件不变,再向容器中通入1molA和1molD,平衡不移动
C. 实验III达平衡后容器内的压强是实验1的9/10倍
D. K3>K2>K1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300 ℃时,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
2 C(g)+2D(g) ΔH=Q, 2 min末达到平衡,生成0.8 mol D。
(1)300℃时,该反应的平衡常数表达式为K=______________,已知K300℃<K350℃,则ΔH____0(填“>”或“<”)。
(2)在2 min末时,B的平衡浓度为________,D的平均反应速率为________。
(3)若温度不变,缩小容器容积,则A的转化率________(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素能够形成多种化合物。请回答下列问题:
(1)联氨(N2H4)常温下为液态,在空气中迅速完全燃烧生成N2,同时大量放热,可作导弹、宇宙飞船、火箭的燃料。
已知:H2(g)+1/2O2(g) = H2O(l) △H1= —285.8kJ/mol
N2(g)+2H2(g) = N2H4(l) △H2= + 50.6kJ/mol
则N2H4(l)在空气燃烧生成液态水的热化学方程式为_______________________。
(2)利用氨气生产氢氰酸(HCN)的反应CH4(g)+NH3(g)=HCN(g)+3H2(g)△H>0
①一定温度下,向2L恒容容器中充入1molCH4(g)和2molNH3(g)发生上述反应,4min达到平衡时,测得CH4平衡转化率为66.67%,0~4min内,用H2表示的该反应速率v(H2)=___________。保持温度和容积不变,再向平衡后的容器中充入2molNH3和2molH2,此时v正 ___v逆(选填“>”“<”或“=”)。
②平衡体系中HCN的物质的量(n)随某物理量变化曲线如图所示(图中x、L分别表示温度或压强)。
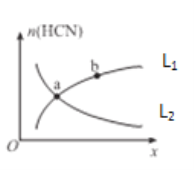
若x为温度,则曲线,____(选填“L1”或“L2”)能正确表示n(HCN)与温度的关系;
若x为压强,则曲线____(选填“L1”或“L2”)能正确表示n(HCN)与压强的关系。
(3)NH3能够形成Ag(NH3)2+。
已知溶液中存在Ag+(aq)+2NH3(aq)==Ag(NH3)2+(aq),常温下该反应平衡常数K1=1.10×107,反应AgCl(s)+2NH3(aq) ![]() Ag(NH3)2+(aq) +Cl-(aq)的化学平衡常数K2=1.936×10-3,则Ksp(AgCl)=____________。
Ag(NH3)2+(aq) +Cl-(aq)的化学平衡常数K2=1.936×10-3,则Ksp(AgCl)=____________。
(4)硫氧化物和氮氧化物是常见的大气污染物,利用如图所示装置(电极均为惰性电极)可吸收SO2,并用阴极排出的溶液吸收NO2。
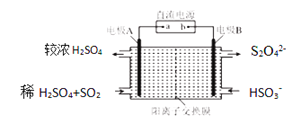
①电极A的电极反应式为__________________________________。
②在碱性条件下,用阴极排出的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应离子方程式为________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com