
分析 (1)(2)实验室中能够加热的仪器有两种:直接加热的仪器有:试管、燃烧匙、蒸发皿和坩埚等;需要垫石棉网的是:烧杯、烧瓶、锥形瓶等;不能加热的仪器有:容量瓶、漏斗、量筒、集气瓶、广口瓶等;
(3)带有活塞或瓶塞的装置使用前要检查是否漏水.
解答 解:(1)试管、蒸发皿可以直接用酒精灯加热,不需要垫上石棉网,故选①④,
故答案为:①④;
(2)烧杯、锥形瓶、蒸馏烧瓶不能直接加热,加热时需垫石棉网加热,故选②⑤⑦,
故答案为:②⑤⑦;
(3)⑧分液漏斗使用前需要检验是否漏水,
故答案为:⑧
点评 本题考查了常见仪器的使用方法,题目难度不大,注意掌握常见仪器的构造及使用方法,试题侧重基础知识的考查,培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 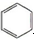 +HNO3$→_{△}^{浓硫酸}$ +HNO3$→_{△}^{浓硫酸}$ 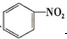 +H2O;取代反应 +H2O;取代反应 | |
| B. | CH2═CH2+Br2→CH2Br-CH2Br;加成反应 | |
| C. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;取代反应 | |
| D. | CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O;酯化反应也属于取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原CuSO4溶液的浓度为1mol/L | |
| B. | 若要使电解后的溶液恢复至电解前的CuSO4溶液,则需加入9.8gCu(OH)2固体 | |
| C. | 电解过程中转移电子数为0.4NA个 | |
| D. | 假设电解过程中忽略溶液体积变化,则电解后所得溶液中C(H+)=0.1mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
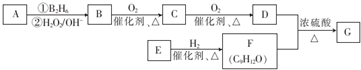
 ;该反应的反应类型为酯化反应或取代反应.
;该反应的反应类型为酯化反应或取代反应.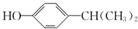 .
.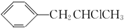 为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):
为原料也可合成F,请参考题目中的相关信息写出相应的合成路线图(反应条件中的试剂写在箭头上方,其他写在箭头下方):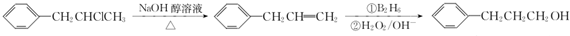 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO和HCl | B. | CH4和NH3 | C. | CH4和HCl | D. | H2和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
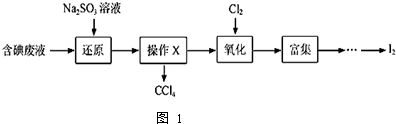
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com