
(7分)
(1)某电解质溶液中,可能大量存在有Ag+、H+、CU2+、CO32-、OH-、Cl-离子,你认为一定有的离子是 ,一定没有的离子是 ;
(2)铜、铁、锌等质量合成的合金Wg,加入FeCl3和盐酸的混合液中,充分反应后:
①若无固体剩余,则溶液中的阳离子一定大量存在的是 。
②若剩余固体为W/3g,则溶液中的阳离子一定大量存在的是 。
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:

 H++SeO42-,K2=1.0×10-2(298K)
H++SeO42-,K2=1.0×10-2(298K)查看答案和解析>>
科目:高中化学 来源: 题型:
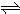 Cu2++2OH-,Ksp=c(Cu2+)?[c(OH-)]2=2×10-20.当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.
Cu2++2OH-,Ksp=c(Cu2+)?[c(OH-)]2=2×10-20.当溶液中各离子浓度方次的乘积大于溶度积时,则产生沉淀,反之固体溶解.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (2013?德州模拟)铁、铝及其化合物在生产和生活中有着广泛的应用.
(2013?德州模拟)铁、铝及其化合物在生产和生活中有着广泛的应用.
| ||
| ||
| 放电 |
| 充电 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com