
【题目】已知亚硫酸钠在空气中能被氧气氧化成硫酸钠。某兴趣小组为检验亚硫酸钠固体是否变质及探究二氧化硫的性质,设计了如下实验:

I.检验Na2SO3是否变质
(1)往圆底烧瓶A中加入待测液1.0 mol/LNa2SO3溶液50mL溶液a为_______,溶液b为_______。
(2)向装置A中滴加足量溶液a,Na2SO3反应完全后,微热装置A使SO2完全逸出。实验前后测得C装置增重2.4g,则Na2SO3溶液物质的量浓度为_______mol/L,并判断Na2SO3固体是否变质______(填是或否)。

II.利用以上装置制备适量SO2,设计实验比较H2SO3、 H2CO3和H2SiO3的酸性强弱,并探究SO2的化学性质。
(1)试剂X是___________;试剂Y是___________;试剂Z是___________。
(2)关闭止水夹b,打开止水夹a,向装置中通入SO2,当观察到_________,即证明H2CO3酸性比H2SiO3强。
(3)关闭止水夹a,打开止水夹b,继续通入SO2,溴水褪色,说明SO2具有_______;写出相应的离子方程式______________________。
【答案】浓硫酸 浓硫酸 0.75 是 酸性高锰酸钾溶液(其他答案合理即可) 品红溶液 NaOH溶液 品红溶液不褪色,Na2SiO3溶液中有白色沉淀生成 还原性 SO2+Br2+2H2O=SO42-+2Br-+4H+
【解析】
I.装置A中的亚硫酸钠加入浓硫酸反应生成二氧化硫气体,通过装置B中浓硫酸干燥气体,用装置C吸收二氧化硫,装置D是防止空气中的水蒸气和二氧化碳干扰二氧化硫气体质量的测定,据此解答。
II.二氧化硫与碳酸钠反应生成二氧化碳,二氧化碳通入硅酸钠溶液中生成硅酸沉淀,据此可以比较酸性强弱;二氧化硫具有还原性能被溴水氧化,根据二氧化硫有毒需要尾气处理判断。
I.(1)装置A产生二氧化硫气体,实验室一般用浓硫酸与亚硫酸钠反应生成二氧化硫气体,即a是浓硫酸。又因为生成的二氧化硫中含有水蒸气,水蒸气也能被碱石灰吸收干扰二氧化硫的检验,则通过装置B中浓硫酸干燥气体,即b是浓硫酸;
(2)碱石灰能吸收二氧化硫,所以C装置增重的质量就是二氧化硫的质量,则二氧化硫的物质的量是2.4g÷64g/mol=0.0375mol,根据硫原子守恒可知亚硫酸钠的物质的量是0.0375mol,浓度是0.0375mol÷0.05L=0.75mol/L<1.0mol/L,所以Na2SO3固体已经变质;
II.(1)二氧化硫与碳酸钠反应生成二氧化碳,但生成的二氧化碳中含有二氧化硫会干扰二氧化碳与硅酸钠的反应,需要除去,可以用酸性高锰酸钾溶液除去二氧化硫,为检验是否除尽二氧化硫需要利用品红溶液检验,即试剂X是酸性高锰酸钾溶液,试剂Y是品红溶液;二氧化硫有毒,需要尾气处理,则试剂Z是NaOH溶液。
(2)根据以上分析可知关闭止水夹b,打开止水夹a,向装置中通入SO2,当观察到品红溶液不褪色,Na2SiO3溶液中有白色沉淀生成,即证明H2CO3酸性比H2SiO3强。
(3)关闭止水夹a,打开止水夹b,继续通入SO2,溴水褪色,由于溴水具有氧化性,这说明SO2具有还原性,反应的离子方程式为SO2+Br2+2H2O=SO42-+2Br-+4H+。


科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 三硝基甲苯的分子式为C7H3N3O6
B. 等质量的甲烷、乙烯、1,3-丁二烯分别充分燃烧,所耗用氧气的量依次减少
C.  在核磁共振氢谱中能出现两个峰,且其峰面积之比为3∶1
在核磁共振氢谱中能出现两个峰,且其峰面积之比为3∶1
D. 2,3-二甲基丁烷的核磁共振氢谱中会出现两个峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是( )
A. 98%的H2SO4物质的量浓度为18.4mol/L ,则49%的H2SO4物质的量浓度为9.2mol/L
B. 当2L水吸收44.8L氨气(标况)时所得氨水的浓度不是1molL-1,只有当44.8L(标况)氨气溶于水制得2L氨水时,其浓度才是1molL-1
C. 只含K2SO4和NaCl的混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D. 50mL 1mol/L的AlCl3溶液中的Cl—浓度与50ml 3mol/L的BaCl2溶液Cl—浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的相对分子质量为56。
(1)该烃的分子式为_________________________。
(2)若能使酸性KMnO4溶液褪色,则可能的结构简式为__________________________。
(3)上述(2)中的混合物与足量H2反应后,所得产物共有__________种。
(4)上述(2)中的混合物若与足量HBr反应后,所得产物共有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式磷酸钙[Ca10(PO4)6(OH)2],工业上叫羟基磷灰石或羟磷灰石,是人的牙齿中比较坚硬的物质,在水中有微弱的溶解,这是牙齿损坏的主要原因。氟磷酸钙也称氟磷灰石,它的化学式为Ca10(PO4)6F2,是牙表面牙釉的主要成分。
回答下列问题:
(1)基态钙原子的价层电子排布式为____________。基态磷原子的未成对电子数为______________。
(2)碱式磷酸钙中含氧酸根离子的中心原子杂化类型是______________________,含氧酸根离子的空间构型为______________;
(3)氢氟酸溶液中存在:2HF![]() H2F2,H2F2为一元酸,则氢氟酸溶液中含氟阴离子是______________(填离子符号)。氢氟酸中存在H2F2的原因是______________________________________________。与H2F+互为等电子体的分子是________________(写出一个即可)。
H2F2,H2F2为一元酸,则氢氟酸溶液中含氟阴离子是______________(填离子符号)。氢氟酸中存在H2F2的原因是______________________________________________。与H2F+互为等电子体的分子是________________(写出一个即可)。
(4)O、F、P的电负性由小到大的顺序为______________。
(5)NH3和PH3的构型相似,NH3的键角略大于PH3,从原子结构角度解释其原因:________________。
(6)CaF2晶胞如图所示。位于体内的粒子的配位数为______________。

已知:氟化钙晶体密度为ρg·cm-3,NA代表阿伏加德罗常数的值。
氟化钙晶体中Ca2+和F-之间最近核间距(d)为______________pm(只要求列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)保持营养平衡,是保证身心健康、提高生活质量的有效手段。
①“中国居民平衡膳食宝塔”(见下图),位于第“⑤”层且每天不超过25g的能量物质是________(填字母)。
a.谷类 b.油脂 c.无机盐
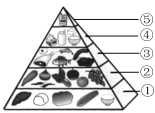
②我国居民在平时的饮食中应多吃碱性食物。下列食物属于碱性食物的是________(填字母)。
a.鱿鱼干 b.菠菜 c.苹果
③绿色植物通过下图储存能量,用化学方程式表示其光合作用的过程:____________________。

(2)材料是人类生存和发展的物质基础,合理使用材料可以改善人类生活。
①我国高速列车制造技术具有世界领先水平。高速列车制造要使用轻质金属材料。下列可以作为轻质金属材料的是________(填字母)。
a.铝合金 b.铁合金 c.碳纤维 d.硅纤维
②青铜在我国有悠久的历史,青铜的主要组成元素是铜和________(填元素符号)。青铜器表面容易生成一层薄薄的铜绿[主要成分是Cu2(OH)2CO3],请写出铜在潮湿的空气中发生电化学腐蚀时的正极反应式:_________________________________________。
③新型有机玻璃透光性好,质轻,耐酸、碱,易于加工成型,强度高,安全性好。有机玻璃属于________(填“合成纤维”“合成橡胶”或“塑料”)材料。特氟龙(聚四氟乙烯)可作为不粘锅涂层,写出该聚合物的结构简式:_____________________________。
(3)保持洁净安全的生存环境已成为全人类的共识,人与自然要和谐相处。
①煤炭直接燃烧引起多种环境问题。治理被酸雨侵蚀过的酸性土壤,可以加入适量的________(填字母)。
a.Ca(OH)2 b.KNO3 c.SiO2 d.CaCO3
②处理含CO、SO2烟道气污染的一种方法是将CO、SO2在催化剂作用下转化为单质硫,写出发生反应的化学方程式:_____________________________。
③据世界卫生组织报道,全世界75%左右的疾病与水体污染有关。污水处理方法很多,例如含氰(CN-)废水的处理,是在碱性条件下,向含氰废水中通入Cl2,可将CN-氧化为无毒的N2和CO2,使水质得到净化。写出该反应的离子方程式:_____________________________。
④消毒是饮用水处理中最重要的环节之一。近年来发展利用ClO2、O3消毒剂替代液氯,主要是人们发现液氯消毒会使水中的多种有机物发生变化,生成有害的物质如___________(填分子式)而可能致癌和致畸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1 NaOH溶液分别滴定100 mL 0.1 mol·L-1 HA、HB两种酸溶液。pH随NaOH溶液体积如下图所示,下列判断错误的是
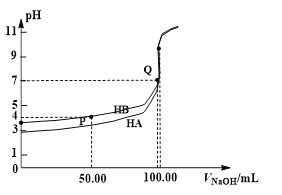
A. 电离常数:Ka(HA) > Ka(HB)
B. Ka(HB)≈10-4
C. pH=7时,c(A—)=c(B—)
D. 中和分数达100%时,HA溶液中存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在如图用石墨作电极的电解池中,放入500mL含一种溶质的某蓝色溶液进行电解,观察到A电极表面有红色的固态物质生成,B电极有无色气体生成。请回答下列问题:
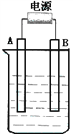
(1)请写出B极板的名称及反应式:_________ ___________________ 。
(2)写出电解时反应的总离子方程式__________________________________________ 。
(3)若当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。电解后溶液的pH为____________ ;要使电解后溶液恢复到电解前的状态,则需加入__________ ,其质量为______________g。(假设电解前后溶液的体积不变)
(4)若原溶液为1L K2SO4、CuSO4的混合溶液,且c(SO42-)= 2.0mol/L;如图装置电解,当两极都收集到22.4L气体(标准状况)时,停止电解。则原溶液中的c(K+)为 _______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯甲酸具有弱酸性,可以和乙醇发生酯化反应生成苯甲酸乙酯。苯甲酸乙酯(密度1.05 g·cm-3)稍有水果气味,用于配制香水香精和人造精油,也大量用于食品以及用作有机合成中间体等。制备苯甲酸乙酯的过程如下:
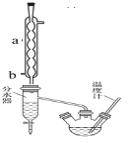
(1)制备粗产品:如图所示装置中,于50 mL圆底烧瓶中加入8.0 g苯甲酸(Mr=122)、20 mL乙醇(Mr=46,密度0.79 g·cm-3)、15 mL环己烷、3 mL浓硫酸,摇匀,加沸石。在分水器中加水,接通冷凝水,水浴回流约2 h,反应基本完成。记录体积,继续蒸出多余环己烷和醇(从分水器中放出)。
(2)粗产品纯化:加水30 mL,分批加入固体NaHCO3,分液,然后水层用20 mL石油醚分两次萃取。合并有机层,用无水硫酸镁干燥。回收石油醚,加热精馏,收集210~213 ℃馏分。
相关数据如下:
沸点(℃,1 atm) | ||||||
苯甲酸 | 苯甲酸乙酯 | 石油醚 | 水 | 乙醇 | 环己烷 | 共沸物(环己烷—水—乙醇) |
249 | 212.6 | 40~80 | 100 | 78.3 | 80.75 | 62.6 |
根据以上信息和装置图回答下述实验室制备有关问题:
(1)写出制备苯甲酸乙酯反应的化学方程式______________________________________,仪器a的名称______________,b口为冷凝水的_____________(填“进水口”或“出水口”)。
(2)请说出在本实验中可以采取的能提高苯甲酸乙酯产率的方法_________________(写出任意一种即可)。
(3)如何利用实验现象判断反应已基本完成______________________________________。
(4)固体NaHCO3的作用______________________________,加入固体NaHCO3时的实验操作所用到的主要玻璃仪器为____________________。
(5)经精馏得210~213℃馏分7.0 mL,则实验中苯甲酸乙酯的产率为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com