
【题目】现有A、B、C、D四种气体,A是密度最小的气体,B在通常情况下呈黄绿色,把四种气体分别通入酸性硝酸银溶液中,通入B、D气体时,立即出现白色沉淀,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D。把无色无刺激气味气体C通入澄清石灰水时变浑浊。
(1)A、B、C、D 的分子式分别为:
A_______________ B_______________C_______________D_______________
(2)写出下列各反应的化学方程式:
A与B______________________________________________
B与水____________________________________________
C与澄清石灰水______________________________________
【答案】H2 Cl2 CO2 HCl H2+Cl2![]() 2HCl Cl2+H2OHCl+HClO CO2+Ca(OH)2=CaCO3↓+H2O
2HCl Cl2+H2OHCl+HClO CO2+Ca(OH)2=CaCO3↓+H2O
【解析】
根据A、B、C、D四种气体,A是密度最小的气体,所以A是氢气,B在通常情况下呈黄绿色,把四种气体分别通入酸性硝酸银溶液中,通入B、D气体时立即出现白色沉淀,所以B是氯气,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D,所以D是氯化氢,把无色无刺激气味气体C通入澄清石灰水时变浑浊,所以C是二氧化碳,据此解答。
(1)A、B、C、D四种气体,A是密度最小的气体,所以A是氢气,B在通常情况下呈黄绿色,把四种气体分别通入酸性硝酸银溶液中,通入B、D气体时立即出现白色沉淀,所以B是氯气,纯净的A可以在B中安静地燃烧,发出苍白色的火焰并生成D,所以D是氯化氢,把无色无刺激气味气体C通入澄清石灰水时变浑浊,所以C是二氧化碳,所以A是H2,B是Cl2,C是CO2,D是HCl;
故答案为:H2;Cl2;CO2;HCl;
(2)A与B的反应是氢气和氯气在点燃的条件下生成氯化氢,化学方程式为:H2+Cl2![]() 2HCl;
2HCl;
B与水的反应是氯气和水反应生成盐酸和次氯酸,化学方程式为:Cl2+H2OHCl+HClO;
C与澄清石灰水的反应是二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
故答案为:H2+Cl2![]() 2HCl;Cl2+H2OHCl+HClO;CO2+Ca(OH)2=CaCO3↓+H2O。
2HCl;Cl2+H2OHCl+HClO;CO2+Ca(OH)2=CaCO3↓+H2O。


科目:高中化学 来源: 题型:
【题目】以粉煤灰(主要成分:Al2O3、SiO2、少量Fe2O3)为原料,制取Al2O3的部分工艺流程如下:

完成下列填空:
(1)铝原子核外有_____种不同能量的电子,最外层电子的轨道式是_____________,上述流程涉及第二周期元素的原子半径由小到大的顺序是______________________________。
(2) “除铁”是将Fe3+转化为Fe(OH)3沉淀,反应的离子方程式为______________________,检验溶液中Fe3+是否除尽的方法是____________________________________________。
(3)解释“结晶”过程中向AlCl3浓溶液中通入HCl气体的原因。______________________
(4)上述流程可循环的物质是_______________。
(5)工业上将Al2O3溶解在熔化的冰晶石中电解获得铝,该反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述正确的是
A.相同温度、相同压强的O2和CO2,两种气体的分子数一定相等
B.相同体积、相同密度的N2和CO,两种气体的分子数一定相等
C.配制450mL 0.1mol·L-1的NaOH溶液,用托盘天平称取NaOH固体1.8g
D.0.45 mol·L-1的NaCl溶液与0.15mol·L-1的AlCl3溶液中含有的Cl-离子数目相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯的化合物与人们的生活紧密相关。回答下列问题:
(1)高血压患者,应该减少食盐的摄入量,为了“减盐不减咸”,建议高血压患者食用低钠盐(含氯化钾30%左右的氯化钠)。我们可以通过________________(操作名称)来检验食盐中含有钾元素,得到食盐中含钾元素的实验依据是___________。
(2)瑞典化学家舍勒(Carl Wilhelm Scheele)将软锰矿(主要成分是MnO2)与浓盐酸混合加热,在世界上首次制得了氯气。实验室用下图所示装置制取纯净的氯气。
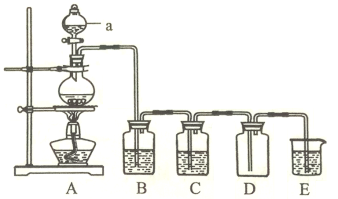
①仪器a的名称为______________。
②装置A中发生反应的离子方程式为_____________________________。
③装置B的作用是_____________,装置C中的试剂为_____________。
④装置E中发生反应的离子方程式为__________________。
⑤当有4molHCl被氧化时,产生的氯气在标准状况下的体积为__________L。
(3)漂白液(有效成分是NaClO)与洁厕灵(主要成分为盐酸)混合,也会产生Cl2,请写出该反应的离子方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是
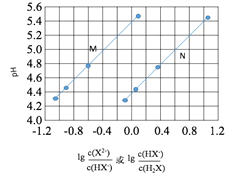
A. Ka2(H2X)的数量级为10-6
B. 曲线N表示pH与 的变化关系
的变化关系
C. NaHX溶液中c(H+)>c(OH-)
D. 当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(H+)=c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某含有SO![]() 、SiO
、SiO![]() 、CO
、CO![]() 、Br-、Na+的溶液中缓慢通入Cl2直至过量,下列对该反应过程的判断不正确的是( )
、Br-、Na+的溶液中缓慢通入Cl2直至过量,下列对该反应过程的判断不正确的是( )
A. 整个过程共发生2个氧化还原反应
B. 所有阴离子的浓度都发生了变化
C. 溶液的颜色发生了变化
D. 反应过程中既有气体产生,也有沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某待测溶液(阳离子为Na+)中只可能含有SO42-、SO32-、Cl-、Br-、NO3-、HCO3-中的一种或若干种,进行下列实验(每次实验所加试剂均足量):回答下列问题:
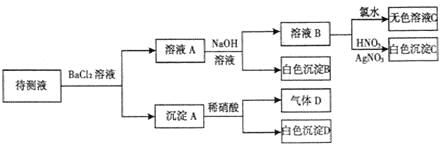
(1)待测液中是否含SO42-、SO32-离子__________________________________________
(2)气体D的化学式为____________,反应生成沉淀B的离子方程式为:____________
(3)根据以上实验,待测液中肯定没有的离子__________________________;肯定存在的离子是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化妆品的组分Z具有美白功效,原从杨树中提取,现可用如下反应制备:
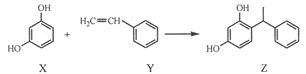
下列叙述错误的是
A. X、Y和Z均能使溴水褪色
B. X和Z均能与NaHCO3溶液反应放出CO2
C. Y既能发生取代反应,也能发生加成反应
D. Y可作加聚反应单体,X可作缩聚反应单体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是聚合物胶黏剂、涂料等的单体,其一条合成路线如下(部分试剂及反应条件省略):

完成下列填空:
(1)反应①的反应类型是____________。反应④的反应条件是_____________。
(2)除催化氧化法外,由A得到![]() 所需试剂为___________。
所需试剂为___________。
(3)已知B能发生银镜反应。由反应②、反应③说明:在该条件下,_______________。
(4)写出结构简式。C________________ M________________
(5)D与1-丁醇反应的产物与氯乙烯共聚可提高聚合物性能,写出该共聚物的结构简式。_____________
(6)写出一种满足下列条件的丁醛的同分异构体的结构简式。____________
①不含羰基②含有3种不同化学环境的氢原子
已知:双键碳上连有羟基的结构不稳定。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com