
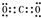 .
.分析 (1)根据原子核外电子排布规律分析;A是碳,再写出二氧化碳的电子式;
(2)铜、锰是过渡元素,镁、铝、硅位于同同期,原子半径依次减小;
(3)硬铝合金的机械性能好;
(4)a.Mg的金属性小于Rb;
b.MgCl2的热稳定性比RbCl强;
c.Mg的还原性小于Rb,则镁离子的得电子能力比Rb+强;
d.根据反应方程式可知生成物Rb为气态,把铷蒸气抽出,则减少了生成物的浓度,根据平衡移动原理分析.
解答 解:(1)硅原子核外有14个电子,根据核外电子排布规律知,每个电子层上最多排2n2个电子,但最外层不大于8个电子,s能级上最多排2个电子,p能级上最多排6个电子,所以硅原子的最外层电子排布式为3s23p2;A是碳,A的氧化物是二氧化碳,二氧化碳的电子式为: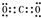 ,
,
故答案为:3s23p2;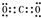 ;
;
(2)铜、锰是过渡元素,镁、铝、硅位于同同期主族元素,在元素周期律中,同一周期元素的原子半径随着原子序数的增大而减小,则Mg、A1、Si 元素的原子半径由大到小的顺序为Mg>A1>Si,
故答案为:Mg>A1>Si;
(3)硬铝合金的机械性能好,密度小(轻巧),硬度大(坚硬)或耐用,是制造飞机的理想材料,
故答案为:密度小(轻巧),硬度大(坚硬)或耐用;
(4)a.铷的金属活动性大于Na,Na的活泼性大于金属Mg,故Rb的活泼性大于Mg,故a错误;
b.MgCl2的离子键比RbCl强,MgCl2的热稳定性比RbCl强,且两者稳定性与真空炼铷的原理无关,故b错误;
c.活泼性越强,对应离子的氧化性越弱,则得电子能力越弱,由于Rb的活泼性大于Mg,则Mg2+得电子的能力比Rb+强,故c错误;
d.已知真空炼铷的原理如下:2RbCl+Mg═MgCl2+2Rb(气),该条件下,生成物Rb为气态,把铷蒸气抽出,则减少了生成物的浓度,平衡向正方向移动,所以反应可以不断向生成Rb(气)方向进行,故d正确;
故答案为d.
点评 本题考查了原子核外电子排布、原子半径大小比较、金属活动性顺序表及其应用,题目难度中等,根据平衡移动原理来分析减少了生成物的浓度平衡正向移动是解答关键,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:选择题
| A. | Cl | B. | Si | C. | C | D. | S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应中Fe2O3是还原剂 | |
| B. | Fe2O3可以通过铁丝在氧气中燃烧制得 | |
| C. | 3molNa2O2反应,有3mol电子转移 | |
| D. | 在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液显中性 | |
| B. | 该溶液中:2 c(Al3+)+c(Fe2+)+c(H+ )=4 c(SO42-)+c(OH-) | |
| C. | 在空气中蒸干并灼烧该溶液,最后所得的残留固体为Al2O3、Fe2O3 | |
| D. | 向该溶液中加入Ba(OH)2溶液,当SO42-完全沉淀时,Al3+、Fe2+恰好被完全沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
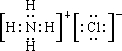 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量的KI溶液与FeCl3溶液反应后,用CCl4萃取其中的I2,分液,在水溶液中滴加KSCN溶液仍呈血红色,说明该反应有一定的限度 | |
| B. | 在一定条件下,一份双氧水样品经过2h,H2O2的浓度从0.05mol•L-1下降到0.03 mol•L-1,该双氧水在这2h中分解的平均反应速率约为0.015 mol•L-1•h-1 | |
| C. | 其它条件相同时,反应温度升高,对于吸热反应,反应速率加快,对于放热反应,反应速率减慢 | |
| D. | 一定条件下,固定体积的容器中发生反应A(g)+B(g)?2C(g),当容器内A、B、C的浓度之比为1:1:2时,该反应一定处于平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X3Y | B. | X3Y2 | C. | X2Y3 | D. | XY3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应 | 铝 | 镁 |
| A | 与非金属 | 能被Cl2、O2氧化 | 能与N2、O2反应 |
| B | 与水 | 能与沸水反应 | 反应很困难 |
| C | 与碱 | 能溶于强碱溶液 | 不反应 |
| D | 与某些氧化物 | 能与Fe2O3、MnO2、Cr2O3等 金属氧化物发生铝热反应 | 能在CO2中燃烧 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com