
| 化学式 | 电离常数 |
| HClO | K=3×10-8 |
| H2CO3] | K1=4.3×10-7 |
| K2=5.6×10-11 |
| A. | c(ClO-)>c(HCO3-)>c(OH-) | |
| B. | c(Na+)=c(HCO3-)+c(CO32-)+c(ClO-)+c(HClO) | |
| C. | c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | |
| D. | c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+C(OH-)+2c(CO32-) |
分析 A.由表中数据可知酸性:H2CO3>HClO>HCO3-,以此判断盐类水解的程度及混合液中各离子浓度;
B.根据物料守恒c(HClO)+c(ClO-)=c(HCO3- )+c(H2CO3)+c(CO32-)=c(Na+)分析;
C.根据物料守恒判断,漏掉了碳酸根离子;
D.根据混合液中电荷守恒判断,阴离子漏掉了碳酸根离子.
解答 解:A.由表中数据可知,H2CO3的酸性大于HClO,则ClO-的水解程度大于HCO3-,则c(HCO3- )>c(ClO-),在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系为:c(HCO3-)>c(ClO-)>c(OH-),故A错误;
B.根据混合液中物料守恒可知:c(HClO)+c(ClO-)=c(HCO3- )+c(H2CO3)+c(CO32-)=c(Na+),则2c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)+c(ClO-)+c(HClO),故B错误;
C.由物料守恒可知,等浓度的NaClO、NaHCO3混合溶液中,c(HClO)+c(ClO-)=c(HCO3- )+c(H2CO3)+c(CO32-)=c(Na+),故C错误;
D.由电荷守恒可知,溶液中一定满足:c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-)+2c(CO32-),故D正确;
故选D.
点评 本题考查离子浓度的大小比较、盐的水解原理,题目难度中等,注意把握弱电解质的电离和盐类水解的原理,结合电荷守恒和物料守恒解答该类题目.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子中含有4个C-H共价键 | |
| B. | 甲烷分子中C-H共价键的夹角为109°28' | |
| C. | 甲烷是正四面体结构 | |
| D. | 甲烷是一种直线型分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
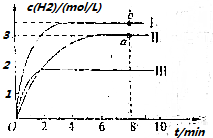 许多含碳、含氢物质是重要的化工原料.
许多含碳、含氢物质是重要的化工原料.| 化学键 | C≡O | O=O | C=O |
| 键能(kJ•mol-1) | 958.5 | 497 | 745 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述过程中,由1 mol CuFeS2制取1 mol Cu时共消耗2 mol O2 | |
| B. | 冶炼过程中的尾气可用来制硫酸 | |
| C. | 在反应2Cu2O+Cu2S=6Cu+SO2↑中,只有Cu2O作氧化剂 | |
| D. | 电解精炼铜的过程中,每转移1 mol电子时,阳极溶解铜的质量为32 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 分子中含有3种官能团 | |
| B. | 可与乙醇、乙酸、溴水发生反应,且反应类型相同 | |
| C. | 1mol分枝酸最多可与2molNaHCO3发生反应 | |
| D. | 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C2H5OH(CH3COOH),加足量CaO,蒸馏 | |
| B. | CO2(SO2),酸性KMnO4溶液、浓硫酸,洗气 | |
| C. | KNO3晶体(NaCl),蒸馏水,结晶 | |
| D. | HNO3溶液(H2SO4),适量BaCl2溶液,过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物水化物的碱性:Y<Z | B. | 简单气态氢化物的热稳定性:X<W | ||
| C. | 简单离子的半径:Y<X | D. | X分别与Z、W形成化合物的熔点:Z<W |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com