
【题目】以铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质)为主要原料生产化工原料红矾钠(主要成分Na2Cr2O7·2H2O),其主要工艺流程如图:

查阅资料得知:
ⅰ.常温下,NaBiO3不溶于水,有强氧化性,在碱性条件下,能将Cr3+转化为CrO42-。
ⅱ.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
回答下列问题:
(1)反应之前先将矿石粉碎的目的是___。
(2)步骤③加的试剂为___,目的是将溶液pH要调到5使Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去。
(3)写出反应④的离子反应方程式___。
(4)⑤中酸化是使CrO42-转化为Cr2O72-,写出该反应的离子方程___。
(5)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠则对粗晶体需要采用的操作是___(填操作名称)。
【答案】增大反应物的接触面积,加快反应速率,提高铬铁矿的浸取率 氢氧化钠溶液(或NaOH溶液) 3NaBiO3+2Cr3++7OH-+H2O=3Bi(OH)3+2CrO42-+3Na+ 2CrO42-+2H+![]() Cr2O72-+H2O 重结晶
Cr2O72-+H2O 重结晶
【解析】
铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质),加入过量稀硫酸,固体A为SiO2,溶液B中含有Cr3+、Al3+、Fe2+,在B中加入过氧化氢,可生成Fe3+,调节溶液pH可除去Fe3+、Al3+,生成氢氧化铁、氢氧化铝沉淀,即固体D,溶液E含有Cr3+,在溶液E中加入NaBiO3和NaOH,发生氧化还原反应,固体G为Bi(OH)3,溶液F含有Na2CrO4,酸化可得Na2Cr2O7,溶液经蒸发浓缩、冷却结晶可得Na2Cr2O72H2O,以此解答该题。
(1)为了增大反应物的接触面积,加快反应速率,提高铬铁矿的浸取率,反应之前可先将矿石粉碎;
(2)根据表格数据分析,步骤③加的试剂为氢氧化钠溶液或NaOH溶液;此时溶液pH要调到5的目的使Fe3+、Al3+均完全转化为Fe(OH)3和Al(OH)3沉淀而除去,而铬离子不沉淀,
故答案为:氢氧化钠溶液(或NaOH溶液);
(3)在溶液E中加入NaBiO3和NaOH发生氧化还原反应,固体G为Bi(OH)3,反应的离子方程式为3NaBiO3+2Cr3++7OH-+H2O=3Bi(OH)3+2CrO42-+3Na+;
(4)酸化使CrO42-转化为Cr2O72-,反应的离子方程式为2CrO42-+2H+![]() Cr2O72-+H2O;
Cr2O72-+H2O;
(5)将溶液H经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,此操作为重结晶。


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案科目:高中化学 来源: 题型:
【题目】标准状况下VL氨气溶解在1L水中(水的密度近似为1g/mL),所得溶液的密度为ρg/mL,质量分数为ω,物质浓度为c mol/L,则下列关系中不正确的是
A. ![]()
B. ![]()
C. ![]()
D. ![]() =1000Vρ/(17V+22400)
=1000Vρ/(17V+22400)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4-CO2催化重整不仅可以得到合成气(CO和H2),还对温室气体的减排具有重要意义。回答下列问题:
(1)CH4-CO2催化重整反应为:CH4(g)+ CO2(g)=2CO(g)+2H2(g) △H=+247kJ/mol;
①有利于提高CH4平衡转化率的条件是____
A. 高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为_______mol2·L2。
(2)反应中催化剂活性会因积碳反应而降低,同时存在的消碳反应则使积碳量减少。相关数据如下表:
积碳反应CH4(g)= C(s)+2H2(g) | 消碳反应CO2(g)+ C(s)= 2CO(g) | ||
ΔH/(kJ·mol1) | 75 | 172 | |
活化能/(kJ·mol1) | 催化剂X | 33 | 91 |
催化剂Y | 43 | 72 | |
①由上表判断,催化剂X____Y(填“优于”或“劣于”),理由是_________________。在反应进料气组成、压强及反应时间相同的情况下,某催化剂表面的积碳量随温度的变化关系如图所示。升高温度时,下列关于积碳反应、消碳反应的平衡常数(K)和速率(v)的叙述正确的是________

A.K积、K消均增加
B.v积减小,v消增加
C.K积减小,K消增加
D.v消增加的倍数比v积增加的倍数‘
②在一定温度下,测得某催化剂上沉积碳的生成速率方v=k·p(CH4)·![]() (k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。
(k为速率常数)。在p(CH4)一定时,不同p(CO2)下积碳量随时间的变化趋势如图所示,则pa(CO2)、pb(CO2)、pc(CO2)从大到小的顺序为________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术发展史上的一项重大突破,研究表明液氨是一种良好的储氢物质。
(1)氨气分解反应的热化学方程式如下:2NH3(g)![]() N2(g)+3H2(g) △H。若:N
N2(g)+3H2(g) △H。若:N![]() N键、H—H键和N—H键的键能值分别记作a、b和c(单位:kJmol-1)则上述反应的△H=______________(用含a、b、c的代数式表示)kJmol-1。
N键、H—H键和N—H键的键能值分别记作a、b和c(单位:kJmol-1)则上述反应的△H=______________(用含a、b、c的代数式表示)kJmol-1。
(2)研究表明金属催化剂可加速氨气的分解。某温度下,用等质量的不同金属分别催化等浓度的氨气,测得氨气分解生成氢气的初始速率(单位:mmolmin-1)与催化剂的对应关系如表所示。
催化剂 | Ru | Rh | Ni | Pt | Pd | Fe |
初始速率 | 7.9 | 4.0 | 3.0 | 2.2 | 1.8 | 0.5 |
①在不同催化剂的催化作用下,氨气分解反应的活化能最大的是______________(填写催化剂的化学式)。
②温度为T时,在恒容的密闭容器中加入2molNH3,此时压强为po,用Ru催化氨气分解,若平衡时氨气的转化率为50%,则该温度下反应2NH3(g)![]() N2(g)+3H2(g)的化学平衡常数Kp=______________。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压P总×体积分数)
N2(g)+3H2(g)的化学平衡常数Kp=______________。(用平衡分压代替平衡浓度计算,气体分压p分=气体总压P总×体积分数)
(3)关于合成氨工艺的理解,下列说法不正确的是______________(填字母)。
A.合成氨工业常采用的反应温度为500℃左右,主要是为了节约能源
B.使用初始反应速率更快的催化剂Ru,不能提高平衡时NH3的产率
C.合成氨工业采用的压强为10MPa~30MPa,是因为常压下N2和H2的转化率不高
(4)在1L1molL-1盐酸中缓缓通入2mol氨气,请在图1中画出溶液中水电离出的OH一浓度随通入氨气的物质的量变化的趋势图。_____________
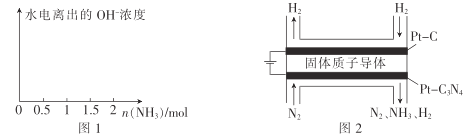
(5)电化学法合成氨:图2是用低温固体质子导体作电解质,用Pt—C3N4作阴极,催化电解H2(g)和N2(g)合成NH3的原理示意图。
①Pt—C3N4电极上产生NH3的电极反应式为______________ 。
②实验研究表明,当外加电压超过一定值后,发现阴极产物中氨气的体积分数随着电压的增大而减小,分析其可能原因:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】α—松油醇是生产香精的重要原料,合成路线如图所示:

(1)α—松油醇中所含官能团的名称为______________。
(2)C→D的反应类型为______________ 。
(3)E→F的反应中有副产物X(与F互为同分异构体)生成,写出X的结构简式:______________。
(4)α—松油醇的一种同分异构体同时满足下列条件.写出该同分异构体的结构简式:______________。
①分子中所有化学键均饱和;
②分子中不同化学环境的氢原子数目比为1:4:4。
(5)已知:RBr![]() RMgBr(R表示经基)。写出以溴乙烷和2—溴丙为烷原料制备
RMgBr(R表示经基)。写出以溴乙烷和2—溴丙为烷原料制备![]() 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。______________
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1.92g铜粉与一定量的浓硝酸反应,当铜粉完全作用时收集到气体1.12L(标准状况下),则消耗硝酸的物质的量是
A.0.12molB.0.09molC.0.11molD.0.08mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一,现有某课外小组自制的氢氧燃料电池,如图所示,a、b均为惰性电极。下列叙述正确的是
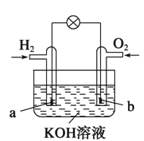
A.总反应方程式为2H2+O2![]() 2H2O
2H2O
B.a极反应是H2-2e-=2H+
C.使用过程中电解质溶液的pH逐渐减小
D.b电极是正极,该电极上发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了将混有Na2SO4、NaHCO3的NaCl固体提纯,制得纯净的氯化钠溶液,某学习小组设计了如下图所示的实验方案:

回答下列问题:
(1)操作①加热过程中,发生反应的化学方程式是_______。
(2)操作②不用Ba(NO3)2溶液的理由是:__________。
(3)进行操作②中,判断“BaCl2溶液是否过量”的方法是:_________。
(4)操作③“加入过量Na2CO3溶液”的目的是:________。
(5)操作⑤中“加适量盐酸”的主要目的是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com