
| A. | 22.4L任何气体的物质的量均为1mol | |
| B. | 标准状况下,1mol物质的体积为22.4L | |
| C. | H2、O2、N2、CO2组成的混合气体1mol在标准状况下的体积约为22.4L | |
| D. | 在同温同压下,相同体积的任何气体单质所含分子数和原子数都相同 |
分析 A.标况下气体摩尔体积是22.4L/mol,温度和压强未知导致无法确定气体摩尔体积;
B.标况下气体摩尔体积是22.4L/mol,只有气体才能用气体摩尔体积计算体积;
C.根据V=nVm计算气体体积;
D.同温同压下,气体摩尔体积相等,相同体积的任何气体物质的量都相等,其分子数相等,根据分子构成判断原子个数是否相等.
解答 解:A.标况下气体摩尔体积是22.4L/mol,温度和压强未知导致无法确定气体摩尔体积,所以无法计算气体物质的量,故A错误;
B.标况下气体摩尔体积是22.4L/mol,只有气体才能用气体摩尔体积计算体积,固体和溶液不适用,故B错误;
C.标况下气体摩尔体积是22.4L/mol,H2、O2、N2、CO2组成的混合气体1mol,根据V=nVm知,在标准状况下的体积约为22.4L,故C正确;
D.同温同压下,气体摩尔体积相等,相同体积的任何气体物质的量都相等,其分子数相等,分子中原子个数不一定相等,所以其总原子个数不一定相等,故D错误;
故选C.
点评 本题考查物质的量有关计算,为高频考点,明确气体摩尔体积适用范围及其适用条件是解本题关键,注意原子个数与物质构成有关,易错选项是D.


 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. | Na+、K+、Br-、NO3- | B. | K+、NH+4、CO32-、Br- | ||
| C. | Fe2+、Na+、MnO4-、Cl- | D. | Cu2+、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
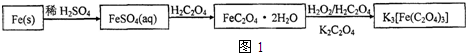
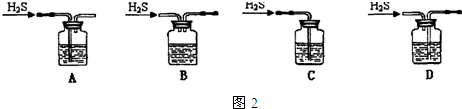
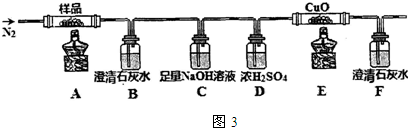
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 物质 | 外观 | 熔点 | 燃烧热/(kJ•mol-1) |
| 金刚石 | 无色,透明固体 | ? | 395.4 |
| 石墨 | 灰黑,不透明固体 | ? | 393.5 |
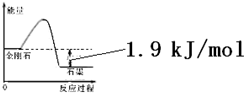
| A. | 由表中信息可得如右图所示的图象 | |
| B. | 由表中信息知C(石墨,s)=C(金刚石,s)△H=+1.9kJ/mol | |
| C. | 由表中信息可推知相同条件下金刚石的熔点低于石墨的熔点 | |
| D. | 表示石墨燃烧热的热化学方程式为C(石墨,s)+$\frac{1}{2}$O2(g)=CO(g)△H=-393.5kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com