
【题目】分析化学中,“滴定分数”的定义为:所加滴定剂与被滴定组分的物质的量之比。以0.10mol·L-1的NaOH溶液滴定同浓度某一元酸HA并绘制滴定曲线如图所示。已知lg3=0.5。下列说法中不正确的是( )
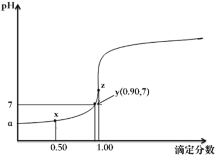
A.该酸碱中和滴定过程应选择酚酞做指示剂
B.根据y点坐标可以算得a的数值为3.5
C.从x点到z点,溶液中水的电离程度逐渐增大
D.x点处的溶液中满足:c(HA)+c(H+)>c(A-)+c(OH-)
【答案】D
【解析】
以0.10mol·L-1的NaOH溶液滴定同浓度某一元酸HA时,a点溶液中只有HA,x点HA与NaA等比混合,y点溶液呈中性,z点为二者恰好完全反应,即z点为滴定终点。
A.由图可知,该酸碱中和滴定的滴定终点为碱性,则应选择酚酞做指示剂,故A正确;
B.根据y点坐标可以算得K(HA)=![]() ,a点时,溶液中只有HA,c(H+)= c(A-),则有
,a点时,溶液中只有HA,c(H+)= c(A-),则有![]() ,解得
,解得![]() ,pH=3.5,故B正确;
,pH=3.5,故B正确;
C.从x点到z点,溶液中的溶质由HA对水的抑制,到NaA对水的促进,水的电离程度逐渐增大,故C正确;
D.x点处的溶液中溶质为HA和NaA等比混合,有质子守恒:c(HA)+2c(H+)=c(A-)+2c(OH-),因为c(H+)>c(OH-),则c(HA)+c(H+)<c(A-)+c(OH-),故D错误;
综上所述,答案为D。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写及评价,均合理的是
选项 | 离子方程式 | 评价 |
A | 用铜电极电解饱和KCl溶液:2H2O+2Cl- | 正确:Cl-的失电子能力比OH-强 |
B | 向CuSO4溶液中通入过量的H2S气体:Cu2++H2S=CuS↓+2H+ | 错误:H2S的酸性比H2SO4弱 |
C | Ba(HCO3)2溶液与足量的NaOH溶液反应:Ba2++HCO3- +OH- ═BaCO3↓+H2O | 错误:Ba2+与HCO3-系数比应为1:2 |
D | 过量SO2通入到NaClO溶液中:SO2+ClO- +H2O= HClO+HSO3- | 正确:H2SO3的酸性比HClO强 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据研究报道,药物瑞德西韦(Remdesivir)对2019年新型冠状病毒(COVID-19)有明显抑制作用。F为药物合成的中间体,其合成路线如下:
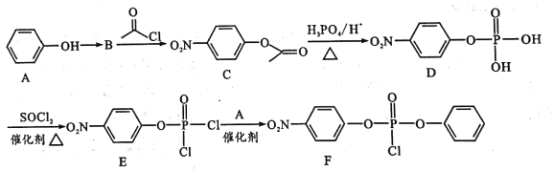
已知:R-OH![]() R-Cl
R-Cl
(1)A中官能团名称是________;C的分子式为_____
(2)A到B为硝化反应,则B的结构简式为___,A到B的反应条件是_____。
(3)B到C、D到E的反应类型 ________(填“相同”或“不相同”);E→F的化学方程式为________ 。
(4)H是C的同分异构体,满足下列条件的同分异构体有_____种。
①硝基直接连在苯环上
②核磁共振氢谱峰面积之比为2:2:2:1
③遇FeCl3溶液显紫色
(5)参照F的合成路线图,设计由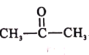 、SOCl2为原料制备
、SOCl2为原料制备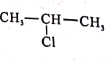 的合成路线_______(无机试剂任选)。
的合成路线_______(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2、O2、熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨I电极反应生成一种氧化物Y,下列有关说法正确的是( )

A.电子由石墨I经负载流向石墨II,再经过熔融盐NaNO3返回石墨I,形成闭合回路
B.Y的化学式可能为NO
C.该装置可以将化学能→热能→电能
D.石墨I极的电极反应式为NO2+![]() ﹣e-═N2O5
﹣e-═N2O5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不粘锅的内壁有聚四氟乙烯涂层,下列关于聚四氟乙烯的说法正确的是( )
A. 聚四氟乙烯的单体是不饱和烃
B. 聚四氟乙烯比较稳定
C. 聚四氟乙烯中氟的质量分数是73.1%
D. 聚四氟乙烯分子中含有双键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是
A. 异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B. 2-氯丁烷(![]() )与NaOH乙醇溶液共热发生消去HCl分子的反应
)与NaOH乙醇溶液共热发生消去HCl分子的反应
C. 甲苯在一定条件下发生硝化生成一硝基甲苯的反应
D. 新戊烷和氯气发生取代反应生成一氯取代物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )

A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[Zn(CN)4]2-在水溶液中可与HCHO发生反应生成[Zn(H2O)4]2+和HOCH2CN,下列说法错误的是( )
A.Zn2+基态核外电子排布式为[Ar]3d10
B.1mol HCHO分子中含有σ键的数目为1.806×1024
C.HOCH2CN分子中碳原子轨道的杂化类型是sp3
D.[Zn(CN)4]2-中Zn2+与CN-的C原子形成配位键,结构可表示为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源的发明是化学对人类的一项重大贡献。
(1)将锌片、铜片按照如图所示装置连接,铜片做__极(填“正”或“负”),外电路电子的流向为__(填“Cu→Zn”或“Zn→Cu”)。

(2)若将装置中的稀H2SO4用CuSO4溶液替代,则相应原电池的总反应的化学方程式为__。
(3)下列化学反应通过原电池装置,可实现化学能直接转化为电能的是__(填序号)。
①NaOH+HCl=NaCl+H2O
②CH4+2O2![]() CO2+2H2O
CO2+2H2O
③Fe+Cu2+=Cu+Fe2+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com