
下列离子方程式与所述事实相符且正确的是( )
A.在强碱性溶液中,次氯酸钠将Mn2+氧化成MnO2:
Mn2++ClO-+H2O===MnO2↓+Cl-+2H+
B.用稀硝酸清洗做过银镜反应的试管:Ag+NO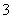 +4H+===Ag++NO↑+2H2O
+4H+===Ag++NO↑+2H2O
C.向FeBr2溶液中通入过量的Cl2:2Fe2++2Br-+2Cl2===2Fe3++Br2+4Cl-
D.用铁棒作阴极、炭棒作阳极电解饱和氯化钠溶液:
2Cl-+2H2O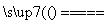 H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
科目:高中化学 来源: 题型:
常温常压下,取下列四种有机物各1mol,分别在足量的氧气中燃烧,消耗氧气最多的是 ( )
A.C2H5OH B.CH4 C.C2H4O D.C3H8
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.25℃,某醋酸溶液的pH=a,将此溶液稀释到100倍后,溶液的pH=b,则a=b-2
B.在氨水的溶液中再加水,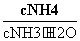 将变大
将变大
C.25℃ 0.5×10-3 mol/L硫酸的pH=3.0,升高温度溶液pH增大
D.25℃,浓度为0.1 mol/L盐酸溶液,水电离出的c(H+)为0.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
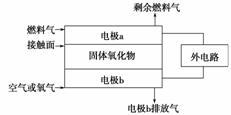
以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高的特点,另外氨气含氢量高,不含碳,易液化,方便运输和贮存,是很好的氢源载体。其工作原理如图所示,下列关于直接氨固体氧化物燃料电池的说法正确的是( )
A.该电池工作时的总反应为4NH3+5O2===4NO+6H2O
B.固体氧化物作为电池工作的电解质,其作用是让电子在电池内移动
C.电池工作时,在接触面上发生的电极反应为2NH3+3O2--6e-===N2+3H2O
D.外电路的电流方向为从电极a流向电极b
查看答案和解析>>
科目:高中化学 来源: 题型:
运用有关概念判断下列叙述正确的是( )
A.1molH2燃烧放出的热量为H2的燃烧热
B.Na2SO3和H2O2的反应为氧化还原反应
C.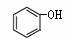 和
和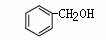 互为同系物
互为同系物
D.BaSO4的水溶液不导电,故BaSO4是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中有CO、H2、O2共16.5g和足量的Na2O2,用电火花引燃,使其完全反应,Na2O2增重7.5g,则原混合气体中O2的质量分数是( )
A.54.5% B.40%
C.36% D.33.3%
查看答案和解析>>
科目:高中化学 来源: 题型:
某强酸性溶液X含有Ba2+、Al3+、NH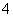 、Fe2+、Fe3+、CO
、Fe2+、Fe3+、CO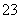 、SO
、SO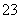 、SO
、SO 、Cl-、NO
、Cl-、NO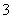 中的一种或几种,取该溶液进行实验,实验内容如下:
中的一种或几种,取该溶液进行实验,实验内容如下:
【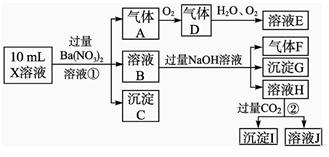 根据以上信息,回答下列问题:
根据以上信息,回答下列问题:
(1)溶液X中除H+外还肯定含有的离子是_____________________________________;
(2)写出有关离子方程式:
步骤①中生成A__________________;步骤②生成沉淀I__________________。
(3)假设测定A、F、I均为0.01 mol,10 mL X溶液中n(H+)=0.04 mol,而沉淀C物质的量0.07 mol,能说明该溶液不能确定的阴离子存在的理由是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一密闭容器中有CO、H2、O2共16.5g和足量的Na2O2,用电火花引燃,使其完全反应,Na2O2增重7.5g,则原混合气体中O2的质量分数是
A. 54.5% B.40% C.36% D.33.3%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com