
 原子序数依次递增且都小于36的X、Y、Z、Q、W四种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Q原子基态时2p原子轨道上有2个未成对的电子,W元素的原子结构中3d能级有4个未成对电子.回答下列问题:
原子序数依次递增且都小于36的X、Y、Z、Q、W四种元素,其中X是原子半径最小的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Q原子基态时2p原子轨道上有2个未成对的电子,W元素的原子结构中3d能级有4个未成对电子.回答下列问题:分析 原子序数依次递增且都小于36的X、Y、Z、Q、W四种元素,其中X是原子半径最小的元素,则X是H元素;Y原子基态时最外层电子数是其内层电子数的2倍,则Y是C元素;Q原子基态时2p原子轨道上有2个未成对的电子,原子序数大于碳,核外电子排布式为1s22s22p4,则Q为O元素;Z的原子序数介于碳、氧之间,则Z为N元素;W元素的原子结构中3d能级有4个未成对电子,外围电子排布为3d64s2,则W为Fe.
(1)Y2X2分子是C2H2,结构式为HC≡CH,分子中C原子轨道的杂化类型为sp杂化,单键为σ键,三键含有1个σ键、2个π键;
(2)化合物ZX3是NH3,在氨分子之间除了存在分子间作用力外还存在氢键,增加了分子之间的吸引力;
(3)等电子体是原子数相同、原子最外层电子数也相同的微粒;
(4)①Fe原子核外电子排布为1s22s22p63s23p63d64s2,失去4s能级2个电子、3d能级1个电子形成Fe3+;
②W(CO)5常温下呈液态,其熔沸点较低,易溶于非极性溶剂,可判断W(CO)x晶体属于分子晶体,在任何化合物中所有元素正负化合价的代数和为0;
(5)A.分子晶体的熔沸点与化学键的强弱无关,只与分子之间的作用力作用;
B.元素的非金属性越强,其电负性就越大;
C.KCl、CaO均属于离子晶体,离子电荷越大、离子半径越小,晶格能越大,熔点越高;
D.H2CO3为弱酸;
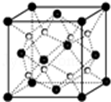
(6)晶胞中白色球数目为8,黑色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则白色球为钠离子、黑色球为氧离子,氧离子周围有8个钠离子,形成立方体结构,再用阿伏伽德罗常数表示出晶胞质量,结合ρ=$\frac{m}{V}$计算.
解答 解:原子序数依次递增且都小于36的X、Y、Z、Q、W四种元素,其中X是原子半径最小的元素,则X是H元素;Y原子基态时最外层电子数是其内层电子数的2倍,则Y是C元素;Q原子基态时2p原子轨道上有2个未成对的电子,原子序数大于碳,核外电子排布式为1s22s22p4,则Q为O元素;Z的原子序数介于碳、氧之间,则Z为N元素;W元素的原子结构中3d能级有4个未成对电子,外围电子排布为3d64s2,则W为Fe.
(1)Y2X2分子是C2H2,结构式为HC≡CH,分子中C原子轨道的杂化类型为sp杂化,单键为σ键,三键含有1个σ键、2个π键,分子中σ键和π键个数比为3:2,
故答案为:sp;3:2;
(2)化合物ZX3是NH3,在氨分子之间除了存在分子间作用力外还存在氢键,增加了分子之间的吸引力,使其的沸点比只有分子间作用力的化合物CH4的高,
故答案为:NH3分子间存在氢键;
(3)等电子体是原子数相同,原子最外层电子数也相同的微粒.元素Y的一种氧化物与元素Z的一种氧化物互为等电子体,它们是CO2与N2O,则元素Z的这种氧化物的分子式是N2O,
故答案为:N2O;
(4)①Fe原子核外电子排布为1s22s22p63s23p63d64s2,失去4s能级2个电子、3d能级1个电子形成Fe3+,基态Fe3+的M层电子排布式为3s23p63d5,
故答案为:3s23p63d5;
②W(CO)5常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,由于其熔沸点较低,易溶于非极性溶剂,所以据此可判断W(CO)x晶体属于分子晶体,在任何化合物水所有元素正负化合价的代数和为0,因此该晶体中W的化合价为0,
故答案为:分子晶体;0;
(5)A.分子晶体中,共价键键能越大,含有该共价键的物质的分子稳定性越强,而分子晶体的熔沸点与化学键的强弱无关,只与分子之间的作用力作用,因此不能判断物质的熔沸点的高低,故A错误;
B.元素的非金属性越强,其电负性就越大,元素的非金属性H<C<N<O,所以电负性顺序:X<Y<Z<Q,故B正确;
C.KCl、CaO均属于离子晶体,离子电荷越大、离子半径越小,晶格能越大,因为晶格能CaO比KCl高,断裂消耗的能量就越大,所以KCl比CaO熔点低,故C正确;
D.H2CO3为弱酸,故D错误.
故选:BC;
(6)晶胞中白色球数目为8,黑色球数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,则白色球为钠离子、黑色球为氧离子,氧离子周围有8个钠离子,形成立方体结构;
根据均摊法计算晶胞中Na+个数、O2-个数,
在一个晶胞中含Na+个数是8;含有O2-个数是4,所以一个晶胞的质量为4×$\frac{62}{{N}_{A}}$g,该晶胞密度为ρ g/cm3,晶胞的边长是acm,则$\frac{4×\frac{62}{{N}_{A}}g}{(acm)^{3}}$=ρ g/cm3,整理可得a=$\root{3}{\frac{248}{ρ{N}_{A}}}$cm,
故答案为:立方体;$\root{3}{\frac{248}{ρ{N}_{A}}}$.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、化学键、配合物、晶胞计算、晶体类型与性质、电负性等,是对物质结构主干知识的考查,(6)中把微观与宏观通过阿伏加德罗常数有机结合在一起,难度中等.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
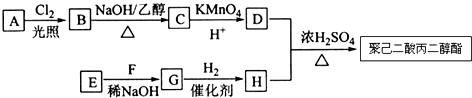
 .
. .
.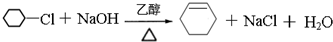 .
.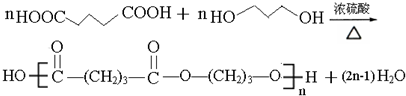 .
.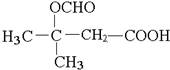 (写出其中一种结构简式).
(写出其中一种结构简式).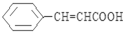 )的合成路线示意图.
)的合成路线示意图.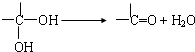
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和氯水中 Cl-、$NO_3^-$、Na+、$SO_3^{2-}$ | |
| B. | c(H+)=1.0×10-13mol•L-1溶液中 ${C_6}{H_5}{O^-}$、K+、$SO_4^{2-}$、Br- | |
| C. | Na2S溶液中 $SO_4^{2-}$、K+、Cl-、Cu2+ | |
| D. | pH=12的溶液中 $NO_3^-$、I-、Na+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业制备NaClO可用电解饱和食盐水的方法离子方程式为:Cl-+H2O $\frac{\underline{\;电解\;}}{\;}$ ClO-+H2↑ | |
| B. | 向NaClO溶液中通入少量SO2气体离子方程式为:SO2+3ClO-+2H2O═2HClO+SO42-+Cl- | |
| C. | 在NaClO溶液中可以大量共存的离子有:K+,SO42-,Fe3+,NO3- | |
| D. | 84消毒液不能和洁厕剂混合使用,也不能用pH试纸测其pH值. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com