

分析 (1)B原子核外电子排布为1s22s22p1;N3-离子核外电子数为10,根据能量最低原理书写;
(2)A.B3N3H6与苯的结构相似;
B.原子总数相同、价电子总数相同(或电子总数相同)的微粒互为等电子体;
C.HB≡NH中的硼原子、氮原子均形成2个σ键,没有孤对电子,杂化轨道数目相同;
D.同周期随原子序数增大,第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,能量较低,第一电离能高于同周期相邻元素;
(3)利用均摊法计算图1的晶胞中含有的粒子总数;与白色球最近的黑色球处于体心位置,每个顶点白色球为8个晶胞共用;
(4)由图可知,B原子与N原子之间4个共价键,其中一个为配位键,生成1molBN时,得到1molNH4Cl,1个铵根离子中也含有1个配位键;
氮化硼与晶体硅均为原子晶体,键长越短,键能越大,晶体熔点越高;
(5)利用均摊法计算晶胞中B、N原子数目,结合阿伏伽德罗常数表示出晶胞的质量,根据m=ρV计算晶胞的质量,联立关系式可求阿伏伽德罗常数.
解答 解:(1)B原子核外电子排布为1s22s22p1,2p能级的1个电子为未成对电子;N3-离子核外电子数为10,核外电子排布式为1s22s22p6,
故答案为:1;1s22s22p6;
(2)A.B3N3H6与苯为等电子体,结构相似,为平面结构,故A错误;
B.BNH6与乙烷是原子总数相同、电子总数相同,二者互为等电子体,故B正确;
C.HB≡NH中的硼原子、氮原子均形成2个σ键,没有孤对电子,杂化轨道数目均为2,杂化方式sp杂化,故C正确;
D.同周期随原子序数增大,第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,能量较低,第一电离能高于同周期相邻元素,故第一电离能B<O<N,故D错误,
故选:BC;
(3)图1的晶胞中含有的粒子总数为1+8×$\frac{1}{8}$+6×$\frac{1}{2}$=5;与白色球最近的黑色球处于体心位置,每个顶点白色球为8个晶胞共用,故白色球的配位数为8,
故答案为:5;8;
(4)由图可知,B原子与N原子之间4个共价键,其中一个为配位键,生成1molBN时,形成1mol配位键,同时得到1molNH4Cl,1个铵根离子中也含有1个配位键,故形成配位键为2mol,
氮化硼与晶体硅均为原子晶体,Si原子半径大于B原子、N原子半径,Si-Si键的键长大于B-N键的键长,故B-N键的键能比Si-Si键的键能大,则氮化硼晶体的熔点比晶体硅的高,
故答案为:2;氮化硼晶体的熔点比晶体硅的高,B-N键的键能比Si-Si键的键能大;
越短,键能越大,晶体熔点越高;
(5)晶胞中B原子数目=N原子数目=4,则晶胞质量为$\frac{4×(11+14)}{{N}_{A}}$g,胞的边长为a nm,密度为ρ g•cm-3,则:$\frac{4×(11+14)}{{N}_{A}}$g=(a×10-7cm)3×ρ g•cm-3,整理得NA=$\frac{1{0}^{23}}{{a}^{3}ρ}$,
故答案为:$\frac{1{0}^{23}}{{a}^{3}ρ}$.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化方式、等电子体、电离能、晶体熔沸点比较、晶胞结构及计算等,(3)中白色球配位数为易错点,学生容易认为顶点黑色球与白色球最近,难度中等.


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:选择题
 甲~辛等元素在周期表中的相对物质如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的~( )
甲~辛等元素在周期表中的相对物质如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的~( )| A. | 金属性,甲>乙>丁 | |
| B. | 原子半径,辛>戊>甲 | |
| C. | 形成的最简单氢化物的稳定性,己>戊 | |
| D. | 丙与庚的元素原子核外电子数相差13 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
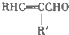 +H2O
+H2O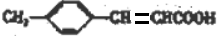 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$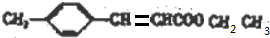 +H2O,反应类型为取代反应(酯化反应).
+H2O,反应类型为取代反应(酯化反应).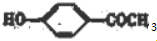 (写结构简式).
(写结构简式).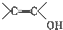 )结构.
)结构.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是从源头上减少和消除化工生产对环境的污染 | |
| B. | 漂白粉和明矾都常用于自来水的处理,二者的作用和原理不同 | |
| C. | 含次氯酸盐的漂白粉与含盐酸的洁厕灵混合使用会产生有毒气体 | |
| D. | 建筑业使用大量的沙,常使用内陆河的河沙及海洋的海沙 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 令人讨厌的地沟油可以用于制肥皂 | |
| B. | 食品中适量添加防腐剂,可以保障安全 | |
| C. | 垃圾分为可回收物、厨余垃圾、有害垃圾、其它垃圾等,废旧电池属于可回收垃圾 | |
| D. | 用红薯酿酒的过程中包含氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=l的溶液中:Mg2+、Na+、AlO2-、SO42- | |
| B. | 含有0.1 mol•L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3- | |
| C. | 含有大量NO3-的溶液中:H+、Na+、Fe3+、Cl- | |
| D. | 含有大量Al3+的溶液中:Ca2+、K+、Cl-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
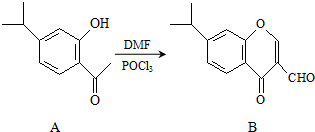 有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )
有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )| A. | 分子A中所有碳原子均位于同一平面 | |
| B. | 用FeCl3溶液可检验物质B中是否混有A | |
| C. | 物质B既能发生银镜反应,又能发生水解反应 | |
| D. | 1mol B最多可与5mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液一定呈酸性 | B. | 溶液中一定存在:Y2-+H2O?OH-+HY- | ||
| C. | 溶液加水稀释,离子浓度都减小 | D. | 溶液中:c(Na+)≥c(Y2-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com