
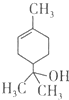
| A. | 1mol该物质最多能和lmol氢气发生加成反应 | |
| B. | 该物质属于烃 | |
| C. | 该物质能使溴水褪色 | |
| D. | 分子式为C9H16O |
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 为减小酸碱中和滴定的使用误差,锥形瓶必须洗净、烘干后使用 | |
| B. | 在氨水中加入少量的水或氯化铵固体后,都会使溶液中的c(H+)增大 | |
| C. | 已知NaAlO2溶液的pH>7,将其蒸干并灼烧后得到的残留物为NaAlO2 | |
| D. | 由H+(aq)+OH-(aq)=H2O(I)△H=-57.3kJ•mol-1,可知100mL 0.1mol•L-1的氨水混合,放出的热量等于0.573kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3- | |
| B. | 酸性溶液中可能大量存在Na+、ClO-、SO42-、I- | |
| C. | 无色溶液中可能大量存在Al3+、NH4+、Cl-、OH- | |
| D. | 红色溶液中可能大量存在Fe3+、K+、Cl-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热NH4C1晶体时,将湿润的红色石蕊试纸靠近试管口,检验NH3的生成 | |
| B. | 取少量溶液X,向其中加入适量新制氯水,再加几滴KSCN溶液,溶液变红,说明X溶液中一定含有Fe2+ | |
| C. | 除去KNO3中的少量NaCl,可将混合物制成热的饱和溶液,冷却结晶,过滤 | |
| D. | 通过灼热的镁粉除去N2中的O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质名称及化学式 | 氯化亚铜CuCl | 碱式氯化铜Cu2(OH)3Cl |
| 性质 | 白色固体、不溶水 | 绿色固体、不溶水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
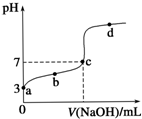 已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )
已知常温时CH3COOH的电离平衡常数为K.该温度下向20mL 0.1mol•L-1 CH3COOH溶液中逐滴加入0.1mol•L-1 NaOH溶液,其pH变化曲线如图所示(忽略温度变化).下列说法中错误的是( )| A. | a点表示的溶液中c(CH3COO-)略小于10-3 mol•L-1 | |
| B. | b点表示的溶液中c(CH3COO-)>c(Na+) | |
| C. | c点表示CH3COOH和NaOH恰好完全中和 | |
| D. | b、d点表示的溶液中$\frac{c(C{H}_{3}CO{O}^{-})•c({H}^{+})}{c(C{H}_{3}COOH)}$ 均等于K |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由①知,氢气的燃烧热为241.8 kJ | |
| B. | 由①、②知,2H2S(g)+O2(g)=2S(g)+2H2O(g)△H=-443.4kJ/mol | |
| C. |  反应②中的能量变化可用如图表示 | |
| D. | 若反应②中改用固态硫,则放热大于20.1 kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com