
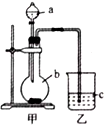
 某同学想通过比较元素的最高价氧化物对应的水化物的酸性强弱来证明硫和碳的得电子能力强弱,设计了如图所示装置进行探究.
某同学想通过比较元素的最高价氧化物对应的水化物的酸性强弱来证明硫和碳的得电子能力强弱,设计了如图所示装置进行探究.分析 比较非金属性的强弱,可根据最高价氧化物的水化物的酸性强弱比较,本题可用稀硫酸与碳酸钠反应验证,C中为澄清石灰水,如变浑浊,则说明生成二氧化碳,可证明硫与碳的得电子能力的强弱.
解答 解:(1)比较非金属性的强弱时用的是最高价氧化物的水化物,因此在分液漏斗中盛放的是稀硫酸,在圆底烧瓶中盛放的是碳酸盐,碳酸钙与稀硫酸反应生成的硫酸钙是一种微溶物,会附着在碳酸钙的表面,将阻止反应的进行,所以选取的碳酸钠为反应物,产生二氧化碳气体用澄清石灰水来检验,
故答案为:稀硫酸;碳酸钠;澄清石灰水;
(2)只要证明圆底烧瓶中有二氧化碳生成,就能说明硫酸的酸性比碳酸的酸性强,即说明硫的非金属性比碳强,因此要用澄清石灰水检验二氧化碳的生成,乙中现象是澄清石灰水变浑浊,所以c中试剂是澄清石灰水,甲中发生的反应为CO32-+2H+═CO2↑+H2O,
故答案:CO32-+2H+═CO2↑+H2O;澄清石灰水变浑浊;
(3)硫酸酸性强于碳酸,反应生成二氧化碳,二氧化碳与澄清石灰水反应生成碳酸钙,所以产生的现象为:澄清石灰水变浑浊;故答案为:硫酸的酸性强于碳酸,所以硫元素的非金属性强于碳元素,硫的电子的能力强于碳.
点评 本题采用实验的方法探究元素周期律,为高频考点,侧重于学生的分析能力和实验能力的考查,同时考查学生理解和综合应用能力,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子层结构相同的离子,随核电荷数的增大其离子半径逐渐减小 | |
| B. | 分子间作用力越强,则分子结构越稳定 | |
| C. | 失电子能力弱的原子得电子能力一定强 | |
| D. | 通过离子键形成的晶体属于离子晶体,通过共价键形成的晶体属于分子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(H+)+c(NH4+ )=c(OH- )+c(HCO3-)+2c(CO32-) | |
| B. | c(Na+ )=c(HCO3-)+c(CO32-)+c(H2CO3) | |
| C. | $\frac{{K}_{w}}{c({H}^{+})}$<1.0×10-7mol/L | |
| D. | c(Cl-)>c(NH4+)>c(HCO3-)>c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 结构与性质 |
| Q | Q元素的最高正、负价代数和为0.最高价氧化物为温室气体之一• |
| W | W是地壳中含量最高的非金属元素. |
| Y | Y所处的周期序数与主族序数相等,为地壳中含量最高的金属元素. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ②④ | B. | ②③⑤ | C. | ①②③⑤ | D. | ①②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
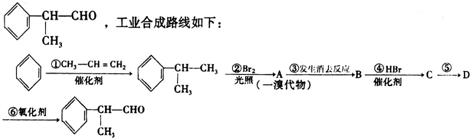
 或
或 .
. .
. +NaOH$→_{△}^{H_{2}O}$NaBr+
+NaOH$→_{△}^{H_{2}O}$NaBr+ ,其反应类型为取代反应.
,其反应类型为取代反应. (或
(或 ).
). 、
、 、
、 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com